Ez a sorozat a hosszabb ideig tartó intenzív edzés hatására létrejövő testen belüli fiziológiai változásokról fog szólni. Fontos kiemelni azt, hogy hosszabb ideig tartó, és intenzív. Ez alatt azt értem, hogy az edzés terjedelme 1-1.5 óra, és az intenzitása minimum a közepes aerob zónában van (>HRMax 70%). Tehát itt legfeljebb csak érintőlegesen fogok kitérni a sprintereknél túlsúlyba kerülő kreatin-foszfát rendszerre, vagy az alacsony intenzitású zsírégetésre. A sorozat megértéséhez elvileg elegendő a középiskolai biokémia, dehát tudjuk, hogy az jó régen volt, és aki először olvas ilyenről, annak ez egyszerre tömény lehet. Szóval ha bármikor a bejegyzések olvasása közben felötlik benned, hogy "OMG!! TOO MUCH SCIENCE!", akkor minden cikk végén vastag betűkkel összegyűjtöttem neked egy TLDR részt, ahol a lényeget összefoglalom.

Az első rész a metabolitikus folyamatokról és a savasodásról fog szólni. Fontos rendbe tenni a kérdést, mert ezzel kapcsolatban még manapság is sok a zűrzavar a fejekben. Edzéselméleti szempontból a metabolizmus ismerete mindennek az alfája és omegája: minden ebből indul ki, vagy ide vezethető vissza, ezért ennek a megértése kritikus fontosságú, és a sorozat többi része masszívan építeni fog az itt leírtakra, úgyhogy érdemes átrágni magad rajta ;)
Gyorsuló metabolizmus
Amint megkezdjük az edzést, már a bemelegítéstől kezdve felgyorsulnak a szervezet energia átalakító anyagcsere folyamatai. Így a belső környezet legfőbb változása - melyből minden egyéb is következik - a gyorsuló metabolizmus, hogy az izmok energiaigényét kielégítse. Az izmok energiaigénye pedig igen nagy: még egy olyan egyszerű gyakorlat esetében is mint a folyamatosan ismételt térdnyújtás, a résztvevő izmok 90 mg cukrot égetnek el percenként, ami kb 24 W kémiai energiát, és 76 W hőenergiát termel (mivel az izomenergia konvertálása csak 22-26%-os hatékonyságú). Ezzel szemben a nyugvó vázizmok metabolikus rátája kb 0.63 W/kg, tehát az inaktív és az aktív izmok energiafogyasztása között mintegy 160-szoros a különbség! Sőt, rövidebb idejű intenzív erőkifejtés energiafogyasztása még ennél is sokkal nagyobb: Egy felnőtt férfi, amikor felugrik egy guggolásból 314 W/kg energiát generál.
Ahhoz tehát hogy megértsük mi történik a szervezetben, amikor a metabolizmus sebessége így megugrik, először meg kell értenünk az alap metabolikus folyamatokat: A glikolízist és az aerob sejtlégzést.
A legtöbb sejt a szervezetünkben elsősorban glükózt bont le, amiből víz és szén dioxid képződik. Ezek a reakciók katabolikusak, tehát energia szabadul fel, melynek egy része az ADP kötések felbontásához és foszfát hozzáadásával ATP szintéziséhez használódnak fel. Másik része hő formájában távozik. Izommunka során zsír vagy cukor szükséges az energiát szolgáltató ATP szintéziséhez, melynek kötési energiája konvertálódik mechanikai munkává, amikor az ATP-ről leszakad egy foszfát csoport.
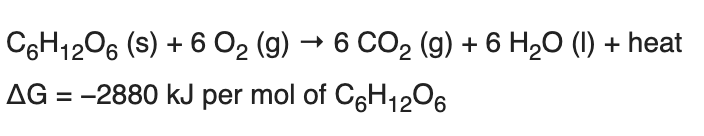
Először a glikolízis során glükóz6-foszfát metabolizálódik piroszőlősavvá (piruváttá) egy 10 reakcióból álló folyamatban. Ez a folyamat oxigén jelenléte nélkül történik a cytosolban, és sokkal gyorsabb mint az oxigént igénylő aerob sejtlégzés. A glükóz-6-foszfát két módon jöhet létre: izom glikogénből (glikogenolisis), vagy a vércukorból (foszforizálás). Az edzés megkezdésekor, amikor még az izom glikogén raktárak (remélhetőleg) telítettek, főként az izomsejtekben lévő glikogén bomlik glükóz-6 foszfáttá. Ilyenkor a glikogén-foszforiláz enzim felhasítja azt a kötést ami a terminális glükóz molekulát a maradék glikogénhoz köti, kicserélve a kötést egy foszforil csoporttal. A glükóz foszforizálása egyrészt azért kell, hogy a reaktivitást növelje (a molekula stabilitását csökkentse), másrészt hogy szabad glükóz ne tudjon visszaszivárogni a cytosolból a vérbe. Intenzív edzés közben az izmokban tárolt glikogén gyorsan lebomlik glükóz-6-foszfátokká, hogy aztán oxidálódni tudjon a glikolízisben.
A glikolízis két fő szakaszból áll: egy "befektetéses" szakaszból, amikor ATP-t használ, és egy "megtérülési" szakaszból, amikor ATP épül újra ADPből és foszfátból. A folyamat végén felszabaduló energiából 3 netto ATP és 2 NADH keletkezik (A 2 piruvát és két hidrogénion mellé).

A glikolízisben először a glükóz-6-foszfát fruktóz-6-foszfáttá izomerizálódik, és ez a folyamat reverzibilis. Ezt követően történik egy ATP felhasználás, amiről is leszakad egy foszfát csoport, hogy a fruktóz-6-foszfáthoz kötődjön. Így keletkezik Fruktóz-1,6-bifoszfát.
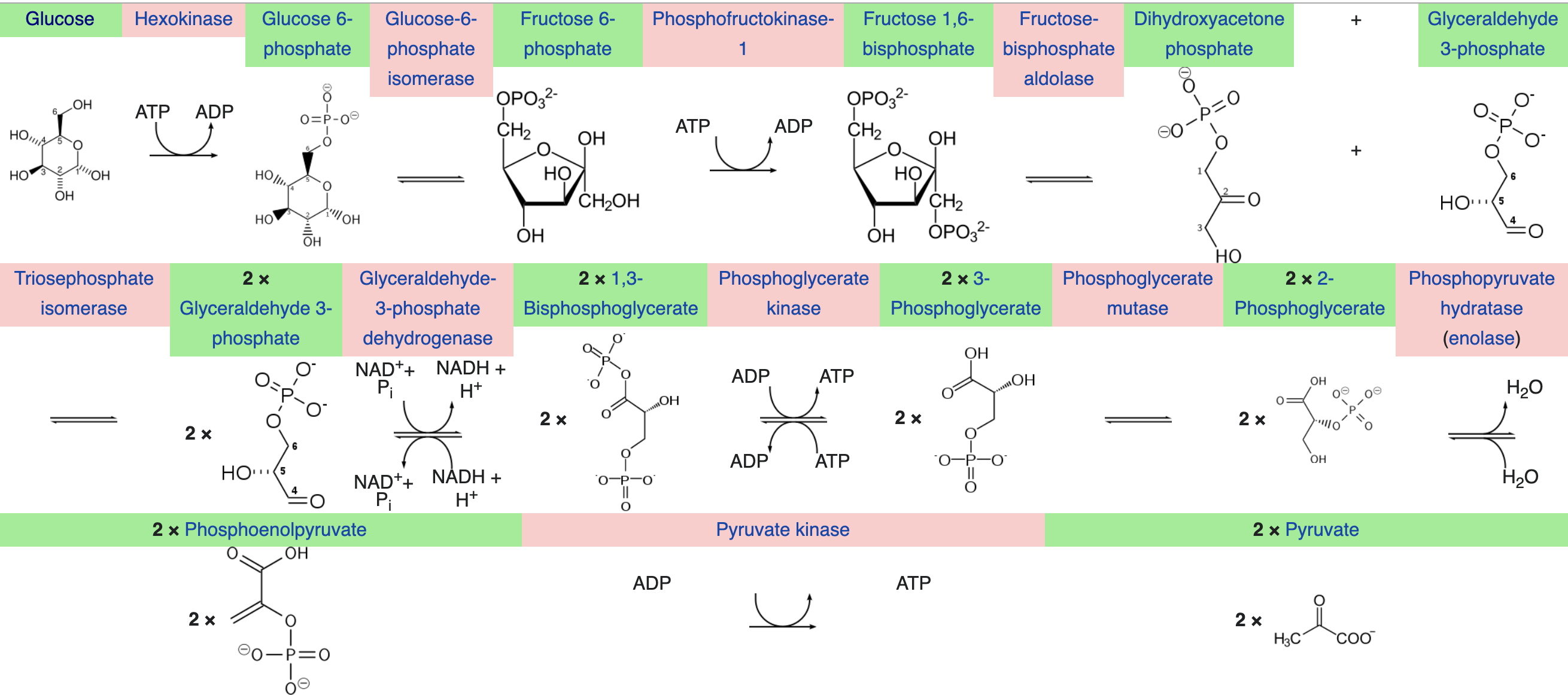
Ezután történik a hexóz két triózra való hasítása: A F1,6-P glyceraldehid-3-foszfátra (G3P) és dihydroxyaceton-foszfátra hasad, ami tovább metabolizálódik G3P-ra. Ezután történik a G3P dehidrogenizálása, amiben a leszakadó hidrogént a NAD+ kapja meg, és NADH keletkezik. A NADH (nikotinamid-adenin-dinukleotid) elektrondonorként fog továbbmenni a mitokondriumban, hogy leadja az elektront terminális oxidációban. Végül a triózok megszabadulnak mindkét foszfátjuktól, melyek ADP-re kerülnek rá. A folyamat utolsó lépésében foszfoenol-piruvátból keletkezik egy alfa-ketosav, a piroszőlősav.
Ezután a mitokondrium felveszi a 2 piruvátot, 2 NADH-t és (2) protont, a piruvát vízzé és széndioxiddá oxidálódik a citromsav ciklus és oxidativ foszforiláció következtében, NADH-t használva elektronvivőként. Ez a folyamat már oxigént igényel, és lassabb mint az anaerob glikolízis. A 2 proton az oxigén redukálásához szükséges az elektrontranszport láncban, miután felvette a két elektront.
A folyamat a következőképpen történik. A glikolízisben keletkezett piruvát először piruvát-dekarboxiláción megy keresztül, melyben a piruvátból Acetyl-CoA oxidálódik a piruvát-dehidrogenáz-komplex segítségével. Az acetyl-coA (Acetyl-coenzim-A) egy fontos magas energiájú köztes molekula, mely a cukorbontáson kívül keletkezhet még zsír- és aminosavbontásból is. A piruvát-dekarboxiláció összekapcsolja a glikolízist a citromsav ciklussal. A piruvát acetyl-CoA konvertálása során 1 NADH, egy szén-dioxid molekula, és egy további proton is keletkezik.
![]()
A glikolízisben keletkezett 2 piruvátból így összesen 2 NADH és 2 Acetyl-CoA lesz.
Ezután az Acetyl koenzim-A bekerül a citromsav ciklusba további oxidálásra. A citromsav ciklus a mitokondriális mátrixban történik. A citrátkör összekapcsolja a legtöbb fontos metabolikus útvonalat: A beta-oxidációt, az aminosav metabolizmust, a glükoneogenesist és a glikolízist. A ciklus lényege, hogy az oxidáció által energiát szabadítson fel további felhasználásra. Az Acetyl-coA-n kívül még vizet igényel és a felszabaduló energia 3 NAD+-ot redukál 3 NADH-ra, így lényegében további elektrondonorokat generál az oxidatív foszforizációhoz. A melléktermékeként
A citromsav ciklus 8 lépésből és 18 különböző enzimből/koenzimből áll. A ciklusban először is az Acetyl-coA kapcsolódik a 4 szénatomos oxálecetsavhoz, hogy 6 szénatomos citrátot alkosson (innen a neve), ami aztán egy még reaktívabb formába rendeződik át (izocitrát). Majd az izocitrát alfa-ketoglutaráttá oxidálódik izocitrát-dekarboxiláz enzim segítségével, mely, ha elhagyja a ciklust maga is fontos prekurzur aminosav szintézishez. Egy NADH is termelődik ebben a lépésben NAD+ból, és a folyamat szén-dioxid felszabadulással jár. Az alfa-ketoglutarát tovább oxidálódik és felvesz egy coA-t, így lesz succinyl-coA. Ez a lépés szintén termel egy NADH-t és szén-dioxidot. A succinyl-CoA aztán borostyánkősavvá alakul, és egy GTP (Guanozin Trifoszfát) molekula keletkezik. Ezután a borostyánkősav fumársavvá alakul a szukszinát-dehidrogenáz enzim segítségével, és a dehidrogenizáció által felszabadult 2 hidrogént egy FAD+ (flavin-adenin-dinukleotid) nevű elektrondonorra teszi. A keletkezett FADH2 az elektron-transzportlánc II.-es komplexének adódik tovább a mitokondriumban. Ezután a fumársavból lesz almasav, amiből végül újra oxálecetsav + egy NADH is termelődik - ezután a ciklus kezdődik előről. Egy ciklus így netto 3 NADH-t (nikotinamid-adenin-dinukleotid), 1 FADH2-t (flavin-adenin-dinukleotid), és egy nagy energiájú GTP-t szintetizál, mely további ATP termeléshez használható. Így egyetlen glükóz6-foszfátból (2 piruvátból) a teljes nyereség 6 NADH, 2FADH2, 6 proton, és 2ATP, valamint 2 CO2 keletkezik melléktermékként.
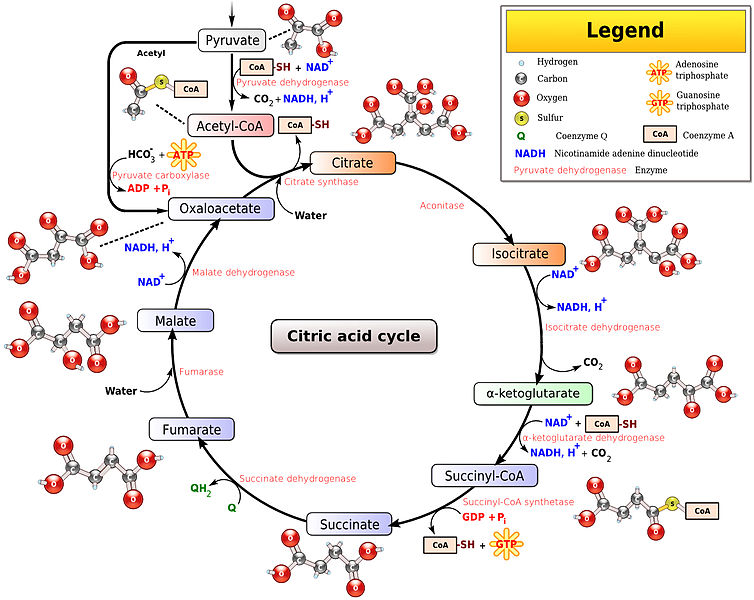
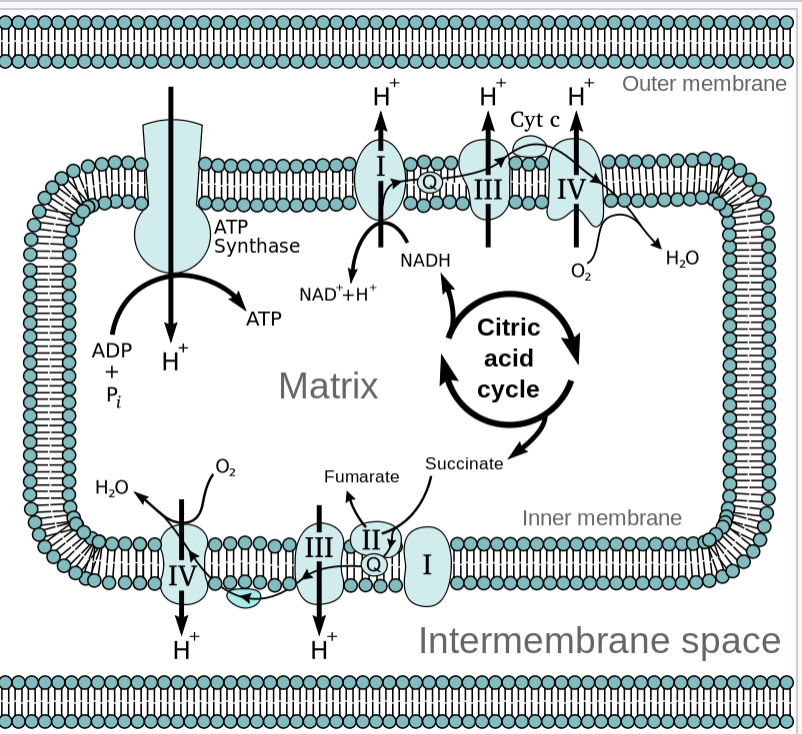
Ezután a citromsav ciklusban keletkezett NADH és FADH2 bekerül az oxidatív foszforizácóba, ahol mint elektrondonorok funkcionálnak, hogy az elektronjukat leadják a belélegzett oxigénmolekulának. Az oxidatív foszforiláció két egységből áll: az elektrontranszport láncból és az ATP szintáz enzimből. Mindkét egység a mitokondriális belső membránba van beágyazva. Az elektron transzportlánc egy elektrondonorból (pl NADH) indul, és a lánc végén az oxigénmolekulák mint végső fogadók kapják meg a szabad elektronokat. A kettő között enzim komplex katalizátorok adják tovább az elektront, és minden egyes fehérjekomplex nagyobb redox potenciállal rendelkezik mint az előtte lévő. Az elektron-transzportlánc funkciója, hogy elektrokémiai grádienst alakítson ki a mitokondriális mátrix és a membránközti tér között. Az elektronáramlás energiát szabadít fel, melyet a protonpumpák kapnak meg, hogy protonokat szállítsanak a membránközti térbe aktív transzporttal, és ezzel protongrádiens generáljanak. Amikor az ATP szintáz ioncsatorna megnyílik protonáramlás történik a membránközti térből az elektrokémiai gradiens mentén lefele a mitokondriumba. Ez a rész spontán történik, és azért van, mert a vízben a hidrogénionok a magas koncentrációjú területről diffundálnak az alacsonyabb koncentrációjú felé. Ezt hívjuk chemiosmosisnak. A protonáramlás mechanikai munkát tesz lehetővé, melyet az ATP szintáz membránfehérje kémiai energiává alakít - a protonáramlásból felszabaduló energiát arra használja, hogy ADP-ből ATP-t szintetizáljon.
Az Oxigénnek az oxidatív foszforilációban abban van a jelentősége, hogy egy magas redox potenciálú molekula, így könnyen vesz fel elektront - Hiányában az elektronáramlás nem tudna megindulni a transzportláncban, és a köztes protonpumpák nem jutnának energiához a koncentráció gradiens kialakításához, ami meggátolná az ATP termelést. Az elektrontranszport lánc exoterm, vagyis energiát szabadít fel, az ATP szintáz enzimreakció endoterm, vagyis energiát nyel el. A két reakció van "összekapcsolva" megtartva a termodinamikai egyensúlyt. Az elektrontranszportláncban felszabaduló energia nagysága jelentős az anaerob glikolízisben felszabaduló enerigához képest, mert az oxigén molekulák kettős kötése nagy energiát raktároz és könnyen felszakítható. A felszabaduló energia kb 42%-a fordítódik ATP termelésre, és 58%-a hő formájában távozik - de a hőtermelés aránya termogenesissel szabályozható.
Egy ATP szintáz 9 protont transzlokál és 3 ATP-t termel rotációként, ezen kívül kell még egy proton az ADP-ATP transzlokáznak is. Így összesen egyetlen ATP termeléshez 4 proton kell. A protonpumpák a belső membránon keresztül 10 protont pumpálnak minden NADH-ra, vagy 6 protont minden FADH2-ra. A két reakció össze van kapcsolva, és ez megadja nekünk, azt a határt hogy összesen mennyi ATP tud keletkezni egyetlen elektrondonorból:
1 NADH+H+ : 10 H+ : 10/4 ATP = 1 NADH+H+ : 2.5 ATP
1 FADH2 : 6 H+ : 6/4 ATP = 1 FADH2 : 1.5 ATP
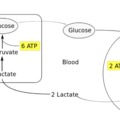
Természetesen ez nem azt jelenti hogy szó szerint 2.5 ATP keletkezik, hanem azt, hogy az ATP szintáz "vár" amíg megfelelő mennyiségű proton a rendelkezésére nem állt - így a 2.5 egy átlagérték. Számoljuk tehát össze, hogy mink van eddig. Egyetlen glükóz-6-foszfátból a glikolízisben keletkezett nekünk 2 NADH és 3 ATP, a piruvát-dekarboxilázban 2 piruvátból 2 további NADH. A citromsav ciklusban 6 NADH, 2 FADH2, és 2 további ATP. Összesen tehát eddig van 10 NADH és 2 FADH2. A 10 NADH-ból keletkezik kb 25 ATP, a 2 FADH2-ból 3 ATP, ez tehát átlagosan 28 ATP csak az oxidatív foszforizációban. Láthatjuk hogy intenzív edzés esetén az aerob energiatermelés oroszlánrészét az oxidatív foszforizáció adja.
A 28 ATP-hez hozzájön a glikogénbontásból keletkezett 3 ATP + a citromsavciklusból a 2 GTP-ból szintetizálódik még 2 ATP, és így kijön hogy az aerob sejtlégzésből átlagosan 33 ATP termelődik. Az elektron transzportlánc végén egy oxigénmolekula összesen 4 elektront fogad, és a mitokondriumból még további 4 protont von el, így keletkezik belőle 2 vízmolekula, mely izzadság formájában távozik. Az elektronok kis része azonban nem jut végig az egész láncon, hanem közvetlenül az oxigénhez szivárog, ami szabad gyök szuperoxid képződéséhez vezet - ami egy nagyon reaktív molekula és felhalmozódása az oxidatív stresssen keresztül hozzájárul az öregedéshez.
A továbbiakhoz lényeges kiemelni a mitokondrium masszív protonfogyasztását. 1 NADH oxidálásához az oxigén 4 protont von el, így egyetlen glükóz oxidálása 40 proton elfogyasztásával jár.
Izomkontrakció gyorstalpaló
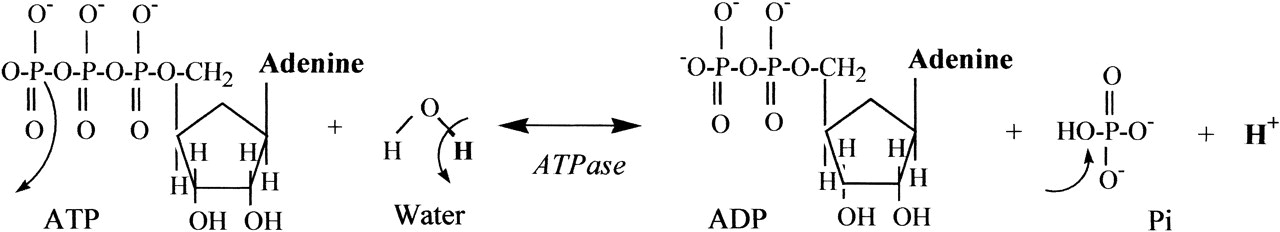
Az aerob sejtlégzésben keletkezett ATP harmadik foszfát kötése könnyen felszakítható. Az ATP hidrolizálásával, a kötés felbomlásával nagy energia szabadul fel. Ez az energia további anyagcsere folyamatokhoz és izom kontrakcióhoz is felhasználható.
Az izomkontrakcióhoz viszont az aktin szálak kötőhelyeinek először fel kell szabadulnia, hogy a miozinvégek hozzákapcsolódhassanak - ami a troponinhez kapcsolódó 2 kalcium ion hatására kiváltott alloszterikus komformációváltozás útján történik. A troponin alakjának megváltozása elengedi a tropomiozin szálakat, amik előtte blokkolták a miozin kötőhelyeket. Az izom kontrakcióhoz tehát elengedhetetlen hogy megfelelő mennyiségű kalcium legyen raktározva a szarkoplazmatikus retikulumban. Így az edzés előtt 1 órával bevitt kalciumtabletta növelheti a teljesítményt.
Amikor izommunka hatására az ATP energiája felhasználódik hidrolízis által, hidrogén ionok (protonok) szabadulnak fel. Aerob egyensúly (steady state) esetén a mitokondrium még visszaveszi ezeket a szabad protonokat (és a glikolízisből, piruvát-dekarboxilációból keletkező protonokat is) újabb ATP szintézishez – mint láttuk a protonok az oxidativ foszfolizációhoz kellenek, egyrészt az oxigén redukálásához vízre, másrészt a proton grádiens fenntartásához a membárnközti mátrixban. A proton újrahasznosítása megakadályozza, hogy szabad hidrogénionok halmozódjanak fel, és ez fenntartja a neutrális ph szintet.
Acidosis
Ha viszont az intenzitás tovább fokozódik, elérjük az anaerob küszöböt, azt az állapotot, amelynél a szervezet nem jut elég oxigénhez a szükséges ATP szintézis fenntartásához (hypoxia). Ebben az állapotban a mitokondriumok nem képesek tovább abban az ütemben ATP-t gyártani, ami szükséges lenne a sejtek energiapótlására. Hogy az ATP termelést ütemét a szervezet fenntartsa, megnövekszik az anaerob glikolízis aránya, ami gyorsabban képes további ATP-t termelni. Mivel azonban a folyamat végén ebben az esetben a piruvát már nem kerül felhasználásra a citromsav ciklushoz, a cytosolban nagy mennyiségben felhalmozódik. A piruvát itt sav formájában keletkezik és képes disszociálni szabad protont. A savasodás meggátlására a piruvát laktáttá (nem tejsavvá!) redukálódik egy laktát-dehidrogenáz nevű reakcióban. Így maga a laktátképződés éppen a savasodás ellenében hat!
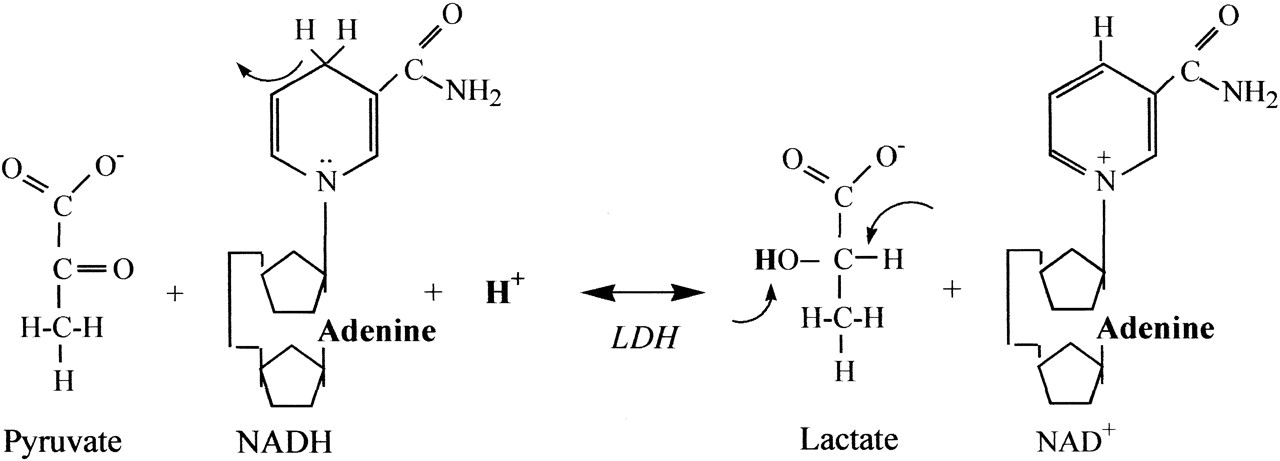
A laktát termelés intracellurálisan szabályozott: a laktát-dehidrogenáz enzim 1 hidrogén kationt (protont) köt meg minden egyes piruvát molekula átalakításánál. Amikor ez a proton puffer rendszer telítődik, akkor szállítanak a sejtek laktátot a véráramba. Ha egy laktát anion a vérbe ürül, a vér elektroneutralitásának fenntartása szükségessé teszi hogy egy kation is a vérbe távozzon, ezzel megint hozzájárulva az izmokban semleges ph fenntartásához.
Bár a megnövekedett anaerob glikolízis kompenzálja az oxidatív foszfolizáció kieséséből származó kevesebb ATP-t, azonban az anaerob folyamat nem képes az ATP bontásából származó szabad hidrogén kationokat megkötni. Emlékezzünk vissza, hogy a szabad protonokat az oxigénmolekula venné fel az elektron transzportlánc végén, hogy vízzé redukálódjon. Egy oxigénmolekula 4 protont venne fel. Hypoxiás állapotban azonban többek között nincs elég oxigén a proton megkötéséhez. Emiatt a proton koncentráció növekszik, és lokális savasodáshoz (acidosis) vezet. Ezt izomfájdalomként, “izomlázként” éljük meg.
Érdemes külön kihangsúlyozni, hogy a hidrogénion felhalmozódás nem a tejsavból származik, mivel a sejtek nem termelnek tejsavat; a piruvát közvetlenül laktáttá alakul – a tejsav anionos formájává, melyben nincs jelen disszociált proton a carboxyl csoportról, így savasodást sem okoz. A laktát pedig nem halmozódik sok ideig az izmokban, hanem perceken belül kiürül a vérbe. Ugyanez a helyzet a glikolízis közbülső savtermékeivel is: Ezekben sem képesek a hidrogénionok disszociálni és szabad protonok sem képződnek, így nem viselkednek savként.
Az anaerob glikolízis köztes reakciói a laktát képződéssel együtt tehát önmagukban semleges folyamatok, abban az értelemben, hogy nem termelnek szabad hidrogén kationokat - viszont a piruvát képződés igen.
Az oxigénhiány (hypoxia) biztosan laktát felhalmozódással és savasodással is jár. A laktát felhalmozódás tehát egy jó indirekt indikátora a hypoxiának, de a laktát maga nem okoz alacsony ph-t, sőt ha az izmok nem termelnének laktátot, akkor a savasodás és izomfáradtság jóval hamarabb bekövetkezne, mert a laktát-dehidrogenáz reakció során minden egyes piruvát molekula katabolizálása laktátra és NAD+-ra egy proton felhasználásával jár, ami így egy pufferként működik a sejten belüli protonfelhalmozódás megakadályozására. A NAD+ keletkezése pedig segít fenntartani a redox potenciált a citosolban, és egy újabb glikolízishez hasznosítható.
A laktát termelésnek további előnyei is vannak. A keletkezett laktátot a monocarboxylate transzporter eltávolítja a sejtből és a véráramba juttatja, innen egyéb szövetekhez juthat (például izomszövetekhez, májhoz, vagy az agysejtekhez), ami felhasználható további glükóz-ATP metabolizmushoz.
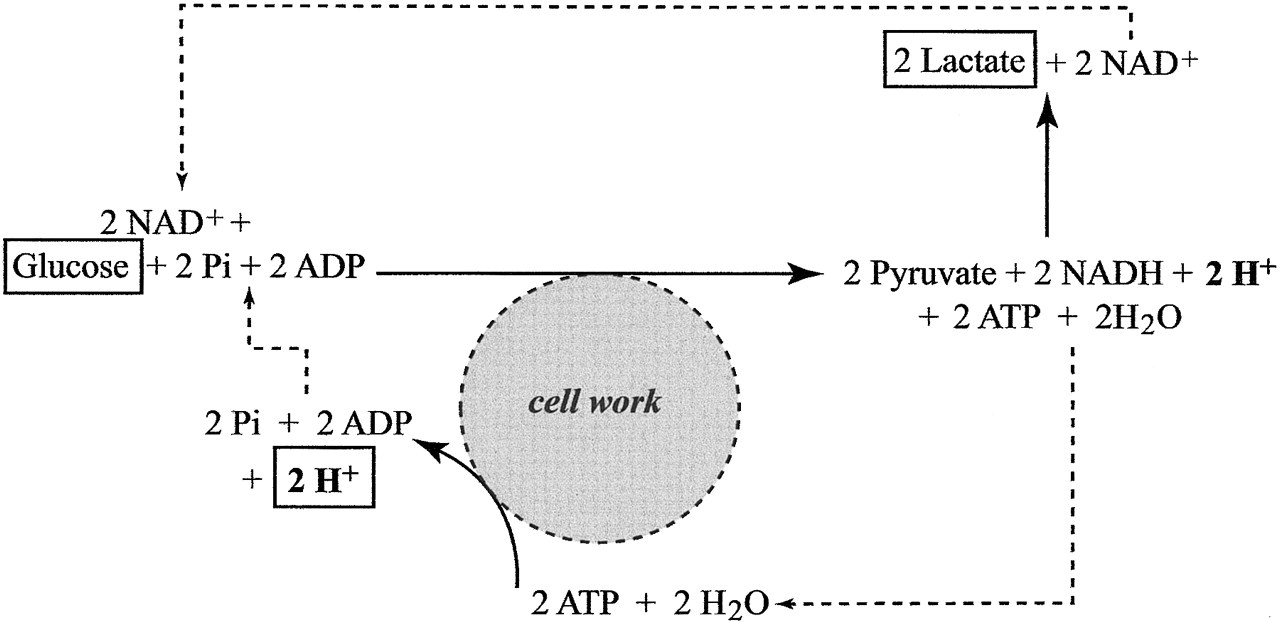
Nem steady state-ben tehát mitokondrium szerepe lecsökken az ATP termelésben, és megnövekszik az anaerob glikolízis túlsúlya, így a mitokondrium nem képes abban az arányban feldolgozni a termelődött szabad hidrogénionokat, melyek az ATP hidrolíziséből keletkeznek, és valójában ez okozza a cytosol proton felhalmozódást és ph csökkenést, vagyis a savasodást. Az ATP hidrolízise egyértelműen a fő forrása a proton felszabadulásának izomkontrakciókor anaerob állapotban.
Fontos megérteni, hogy a laktát képződés egyben puffer rendszerként is működik azáltal hogy protonokat fogyaszt, és mellé proton eltávólítóként is, azáltal, hogy H+ ionokat szállít a szarkolemmán keresztül, hogy megvédje a sejtet a metabolikus savasodástól.
Az intercellurális puffer rendszer, ami magába foglalja az amino savakat, proteineket, foszfátokat, karbonátokat, creatin-foszfátot, hidrolízist, és laktátképződést, protonokat fogyaszt vagy köt meg, ezzel megakadályozva sejten belüli hidrogénion felhalmozódást. A protonok a mitokondriális transzport folyamatok, és szarkolemmális transzport hatására is eltávolítódnak a cytosolból. Ugyanakkor, ha az ATP hidrolízisének aránya túllépi minden más reacióét, a protonfelszabadulás mértéke túllépi a metabolikus proton bufferek kapacitását – a laktát termelést, és kreatinfoszfát lebontást, valamint a foszfát anionok, aminosavak és proteinek proton megkötését. Ráadásul amint a sejtből való laktát/proton eltávolítás is eléri a maximum kapacitását, proton felhalmozódás jön létre a sejten belül. A savasodás valódi oka tehát nem pusztán a proton felszabadítás, hanem a proton felszabadulás mértéke és a proton pufferelés/eltávolítás mértéke közti egyensúly felborulása.
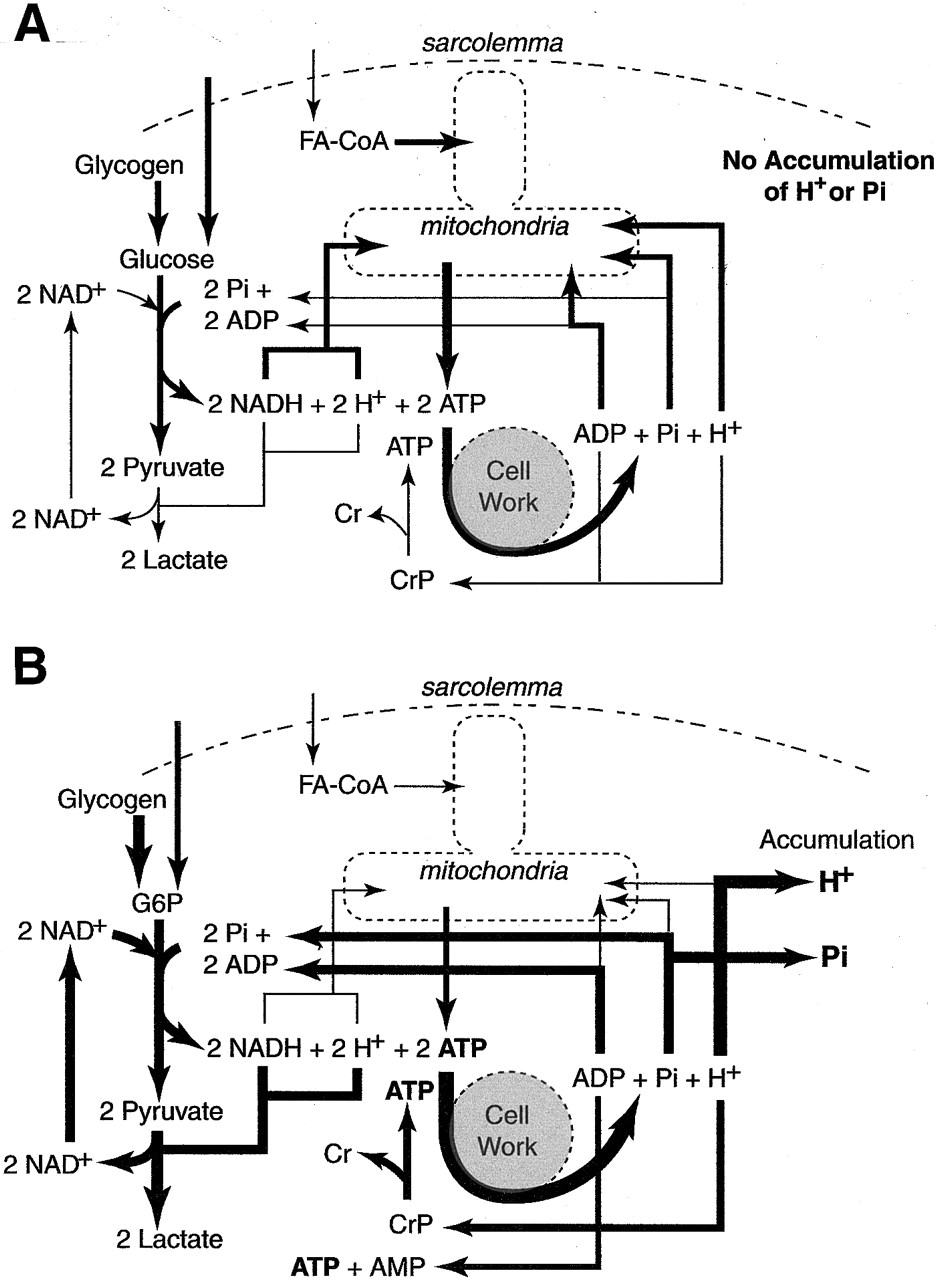
Az anaerob glükózbontás jóval pazarlóbb az aerob légzésnél és gyorsan kiüríti az izom glikogénraktárait, melynek bontásából származik a glycolysishez szükséges glükóz6-foszfát. Ha a glikogénraktárak kiürülnek, a glükózpótlás a vérből történik. A vérből származó cukor glikolízise még ennél is pazarlóbb, mert már csak 2 netto ATP szintézisével jár. Továbbá a vércukor glókóz6-foszfáttá alakítása már Magnézium-ATP hirdolízisével történik, melynek hatására újabb proton szabadul fel, hozzájárulva a további acidosishoz. (Izomglikogén glikolízise 1 netto protonképződéssel jár, míg a vérből származó glükóz esetében a kezdeti ATP hidrolízis miatt ez 2 proton – így izomglikogén mint forrás kevésbé okoz savasodást, mint a vérből származó cukor)
Ha számottevő laktát ürül a vérbe, akkor a protonszállítás miatt savas irányba tolhatja a vér ph-ját ami további komplikációkat okozhat, például hyperventilációt.
Miért olyan fontos az a tény, hogy a savasodást imbalance okozza és nem laktacid felhalmozódás? Ha a laktacid hipotézis igaz lenne, akkor anaerob körülmények között az intenzitás csökkentése csak a további savasodást gátolná, de a felhalmozott tejsav sokkal nehezebben ürülne. Viszont ha tudjuk, hogy az acidosis valójában az proton puffer rendszer egyensúlyának felborulása, akkor az intenzitás csökkentésével, és az "oxigénadósság megtérítésével" ez az egyensúly bármikor helyrehozható.
A savasodás mérséklésére tehát két hatékony eszköz is van:
- A terhelési összetevők paramétereinek gondos megválasztása, hogy ne tartózkodjunk túl sok időt anaerob zónában. Az edzés paraméterei közé tartozik a terhelések intenzitása, időtartama, terhelések közötti pihenőidők hossza, az edzés terjedelme, stb. Amit én szeretek ilyen szempontból az az interval edzés. Egy nagyon izgalmas edzésforma, és a kevésbé intenzív szakaszokban van esélyünk visszanyerni az oxigénhiányt, így visszaállítani az aerob egyensúlyt. Az intenzív szakaszok korlátosak, és rövidek ezért nagyobb a motiváció hogy abban az időben a maximumot hozzuk ki magunkból. A terhelés intenzitásának megfelelően különböző módokon lőhetjük be az intenzív és kevésbé intenzív szakaszok időtartamának arányát.
Sajnálatos látni, hogy sok fitness edző az 1 órás alakformáló órát még mindig képes végigtolni egy túlzsúfult teremben 160-170-es pulzuson 0 pihenővel, pedig némi interval beiktatása jelentősen növelné az edzés hatékonyságát. - A folyamatos oxigénellátás biztosítása. Edzőteremben ez azt jelenti, hogy a szellőztetés az egész edzés időtartama alatt biztosított (akár berendezések akár nyitott ablakok által). Azonban ha sok a résztvevő egy zárt térben, akkor óhatatlanul kevesebb az oxigén-ellátás, mint szabadban, ezért a legjobb megoldás, ha az egész edzés egyszerűen a szabadban, természet közelében történik.
Vannak még egyéb módszerek is, de azokat majd a következő témakörökben fogom tárgyalni.
TLDR:
- A savasodást nem tejsav okozza, hanem az ATP bontásból keletkező proton felhalmozódás
- A laktát ezzel szemben éppen azért keletkezik, hogy megvédje az izmokat a savasodástól
- Minél nagyobb az oxigénhiány, annál erőteljesebb a proton felhalmozódás és a laktát termelés is, de ugye correlation ≠ causation
- Az izmok saját glikogénraktárainak bontása kevésbé okoz savasodást mint a vércukor bontás
- A savasodás mérséklésére egy jó módszer az interval training valamint a megfelelő oxigénellátás (friss levegő) biztosítása
A következő rész a terhelés okozta hypoglikémiáról szól, és építeni fog az itt leírtakra. Stay tuned.
Zalán