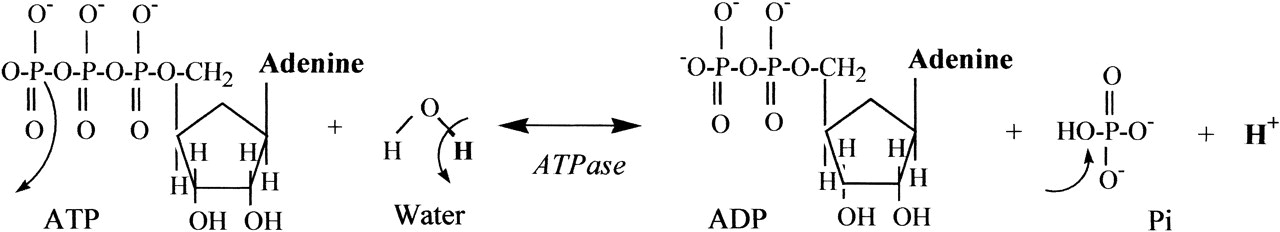
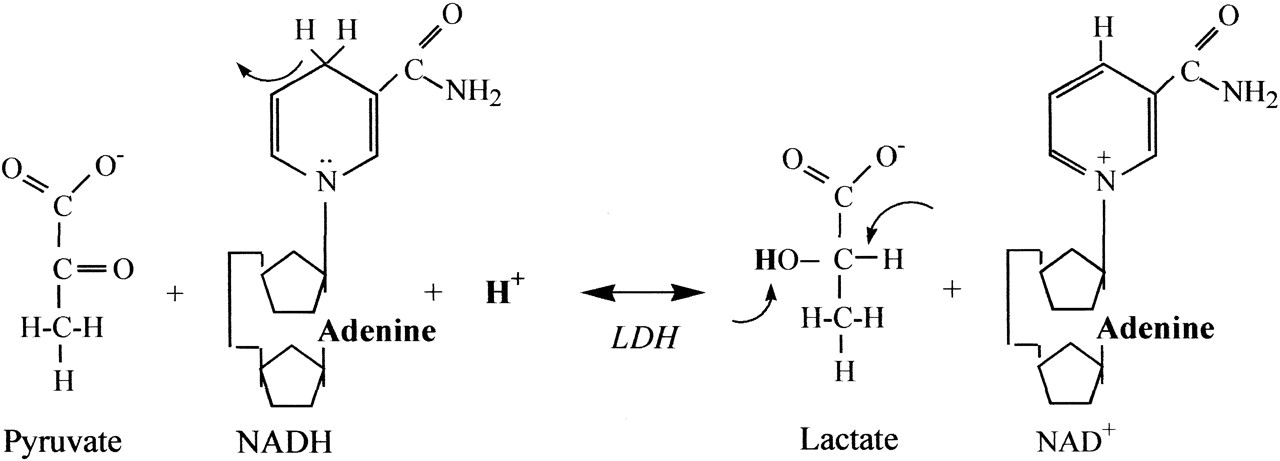
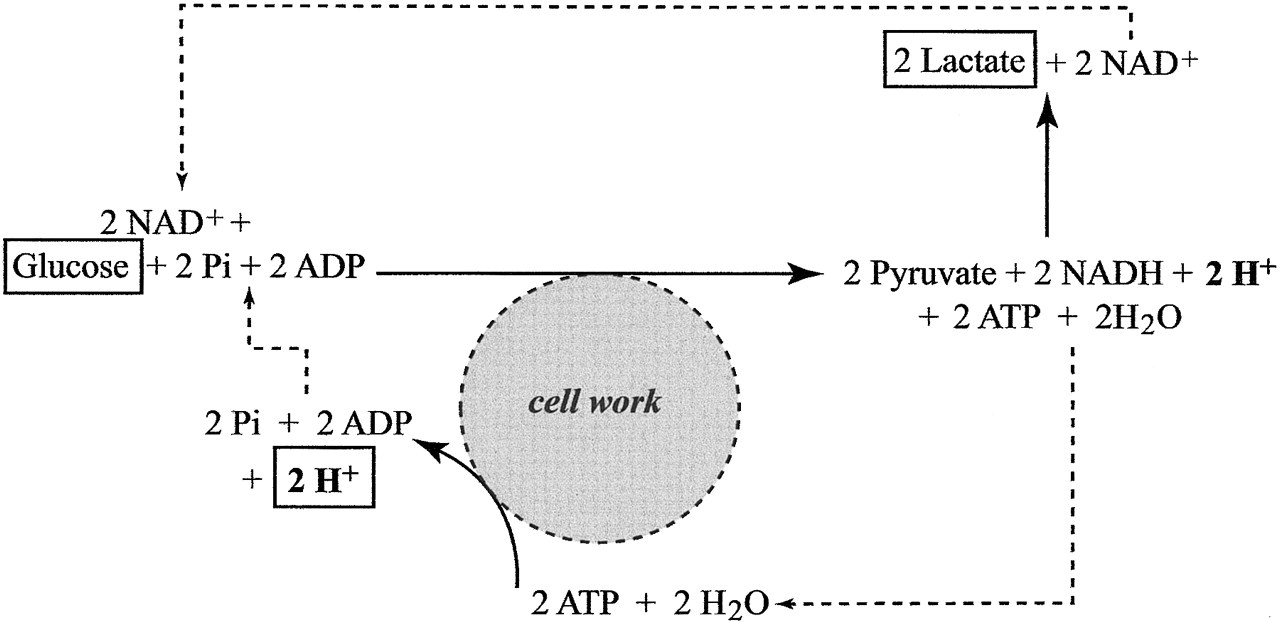
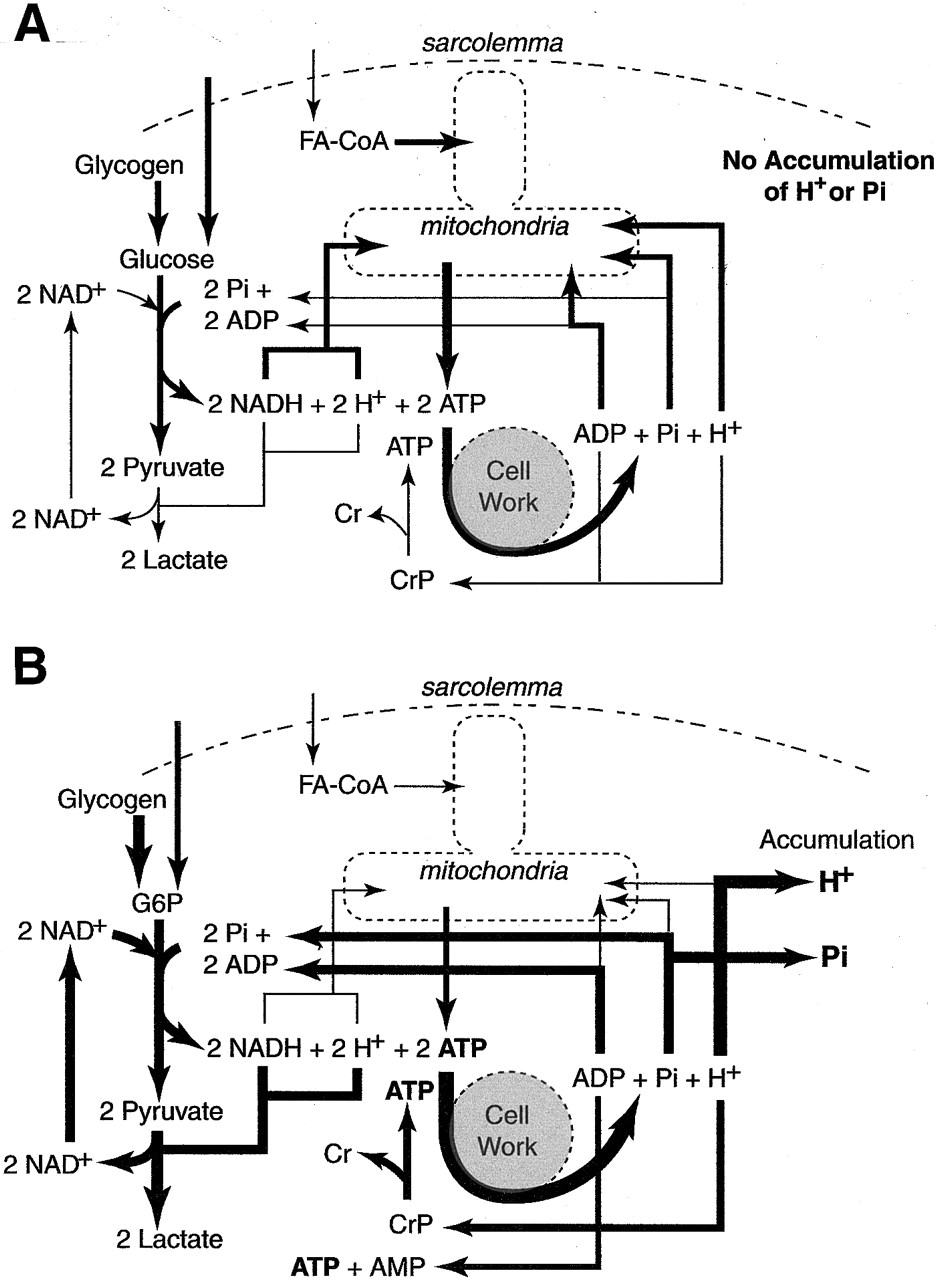
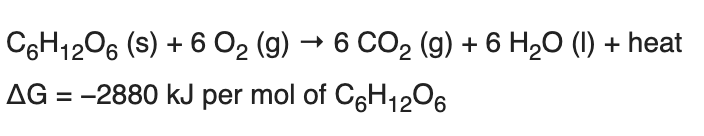Az előző részekből láttuk, hogy a metabolizmus gyorsulásával megnő a szervezet oxigénigénye, hogy a cukrot és a zsírsavakat minél gyorsabban el tudja égetni, és ezzel az izmok megnövekedett energiaigényét biztosítani tudja. Az előző részben tárgyaltuk, hogy a megnövekedett oxigén igény kielégítésére a szervezet úgy reagál, hogy megnöveli a légzés gyakoriságát és mélységét, és ez a folyamat közvetetten szabályozódik, mivel a sejtlégzés által termelt CO2 savas irályba tolja a vér PH-ját, melyet kemoreceptorok érzékelnek. A hyperventiláció azonban csak a vérbe kerülő oxigén és onnan kijutó széndioxid, azaz a gázcsere folyamatát gyorsítja meg, és a légzés gyorsulása önmagában nem elég ahhoz, hogy az oxigén eljusson a szervezet minden pontjára. Ehhez egy másik elengedhetetlen feltétel kell: A vér áramlásának gyorsítása, mely a szív kibocsátásának növelésével valósul meg. Ebben a bejegyzésben tehát arról lesz szó, hogy hogyan szabályozza a szervezet a szív működését, hogy a megfelelő véráramlás (un. bulk flow) biztosítva legyen. Ebben is elég sok lesz az új dolog és viszonylag részletes lesz, de ha nem megy első nekifutásra ne csüggedj: nyugodtan hagyj ki részeket, vagy ha végképp eleged van ugorj a végén a TLDR részhez;)
Amikor a szervezet intenzív terhelés alatt áll, az oxigénnek sokkal gyorsabban és nagyobb mennyiségben el kell tudni jutnia a szervezet minden sejtjéhez, mint nyugalmi állapotban. Az előző részben láttuk, hogy az oxigént a véráramban lévő vörösvérsejtek szállítják, a vörösvérsejtek pedig passzívan, a vér áramlásának segítségével jutnak el a sejtekhez. Most képzeljük el, hogy a járvány miatt az összes liszt kifogyott a vidéki boltokból, ezért lisztet kell elszállítani Budapestről a vidéken élő nagymamának, hogy almás pitét tudjon belőle csinálni. A vonatot választjuk közlekedési eszköznek. Az analógiában a vonat a véráram, mi vagyunk a vörösvértestek, a liszt az oxigén, az almáspite gyártás folyamata pedig az aerob sejtlégzés. Nyugalmi állapotban a véráram olyan mintha a MÁV egyik személyvonatával szeretnénk eljutni az ország bármely távoli pontjába: biztosan rámegy a fél napunk. Ez békeidőben elfogadható, hiszen nagymama tud várni fél napot az almáspite elkészítésével. Ezúttal viszont kiderült, hogy a nagymama spontán ötlettől vezérelve meghívta a nagycsaládot (30 embert) ebédre, most pedig épp fél 10 van - mire leérnénk a nagymamához nem lenne idő almáspitét sütni és természetesen az egész család szörnyethalna. Ilyenkor tehát meg kell növelni a szállítás gyorsaságát - szóval a köztudottan Magyarországon is létező japán mágnesvonatot választjuk, ami a 600 km/h-ás átlagsebességével 15 perc alatt ott van a nagymamánál.

A vér áramlását a szív szabályozza a vér pumpálása által. A véráramlás gyorsításához a pumpálás frekvenciáját és erősségét kell növelni. A szív 'pumpálása' a szívizmok kontrakciójából áll. Itt érdemes már különbséget tenni a szívfrekvencia és pulzus között. A szívfrekvencia a szívizmok kontrakciójának frekvenciáját jelenti, míg a pulzus a perifériákon mért systolés vérnyomás frekvenciája. A systoles szakaszban generált nyomáshullámok megmozdítják az érfalat, és ezt a lüktetést lehet mérni pl a csuklón. A szívfrekvencia lehet nagyobb vagy kisebb is mint a pulzus élettani tényezőktől függően, bár általában elég közel van a kettő egymáshoz. A szívfrekvencia és a pulzus különbsége a pulzus deficit, és főleg arrhythmia-nál vagy ventrikuláris extrasystolenél van jelentősége. (extrasystolenél a bal kamra egy picivel hamarabb húzódik össze mint a normál ritmus, emiatt utána olyan érzés mintha kihagyna egy kört, ami elég kellemetlen)
A szívműködés szabályozása
Bár a szívritmust a szinoatriális csomó önmagában is teljesen szabályozza, normál körülmények között a szívfrekvencia szimpatikus és paraszimpatikus idegrendszeri szabályozás alatt is áll. A szív az egyetlen izom, ami képes idegrendszeri szabályozás nélkül önmagának ritmikus ingert generálni a szinusz csomó által, ez az inger 100 bpm (beat per minute) - így a szívműködés elméletben teljes agyi kóma állapotában is fenntartható. A szinusz csomó a jobb pitvar falán lévő sejtcsoportosulás, ezek a sejtek módosult cardiomyociták (szívizomsejtek), és képesek spontán módon elektromos impulzust (akciós potenciált) generálni, ami aztán végigutazik a szív elektromos hálózatán, ezen keresztül pedig eljut a szívizmokba, ahol az akciós potenciál mechanikai munkává konvertálódik. A szívben a sinoatrialis (SA) csomó folyamatosan akciós potenciált generál, ezzel beállítva a szívfrekvenciát. Az akciós potenciál létrehozásának frekvenciáját az SA node-ot ellátó idegek befolyásolják. Azért hívják sinus csomónak mert egy sinus venarum nevű régióban található, mely az alábbi ábrán az 1-es számnál található. A kék hálózatot a 2-es szám jelöli, és ez vezeti az elektromos ingert a szívizomsejtekhez.
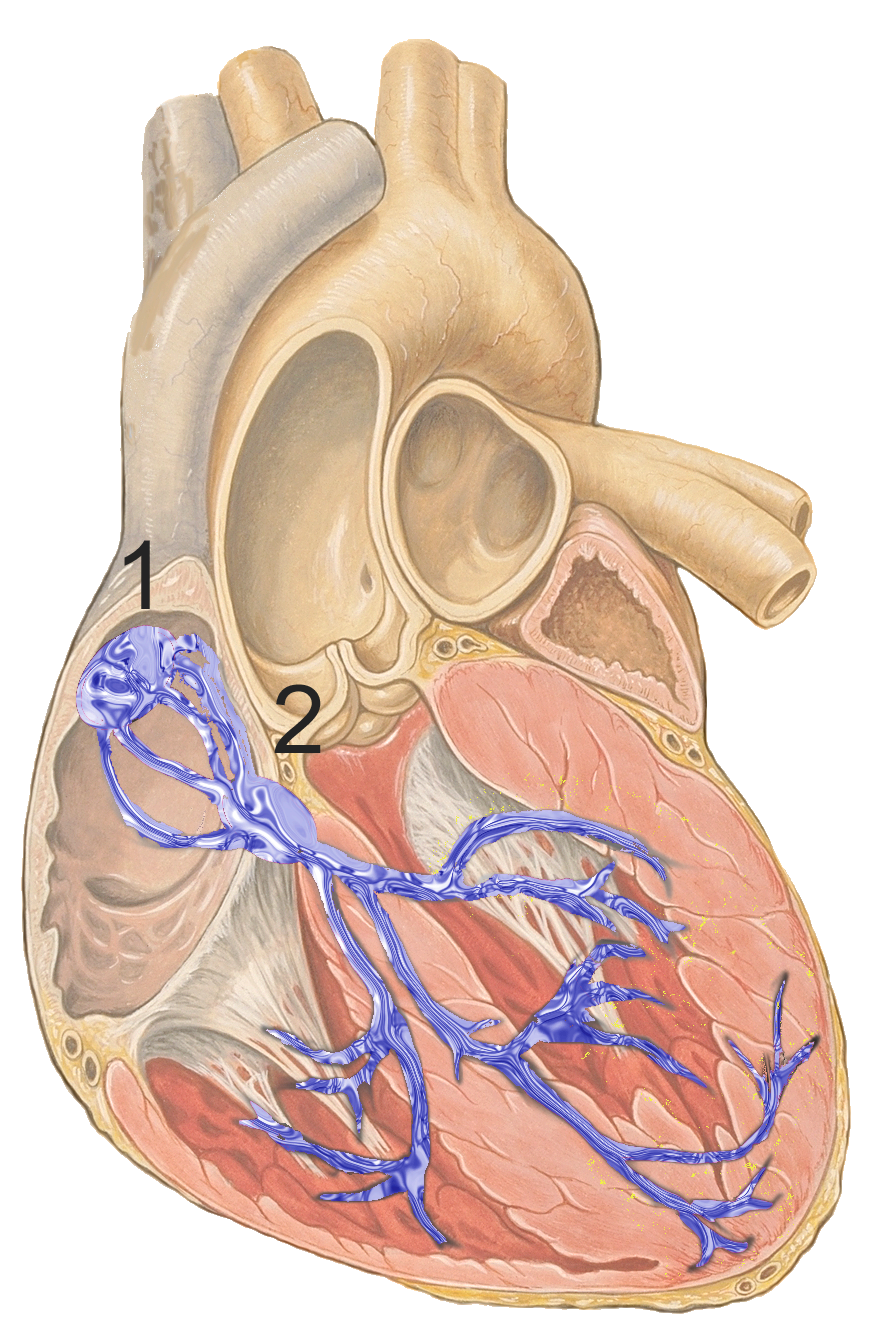
A sinus csomó mint természetes pacemaker
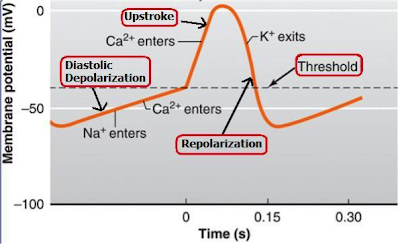
A sinus csomó pacemaker sejtjei egy három fázisos ciklusban generálnak ingert. Az első szakasz a pacemaker potenciál, melyben a sejtek lassan depolarizálódnak, a második szakasz az akciós potenciál, amikor a sejt gyorsan depolarizálódik tovább; a harmadik szakasz a repolarizáció, amikor a membránpotenciál újra visszaáll az eredeti állapotába.
A szinusz csomó működését úgy lehet elképzelni mint egy fesztivált a természetben. Amikor a fesztivál elkezdődik, még minden szép tiszta és zöld. Aztán egyszer csak egy renitens fesztiválozó eldobja az első műanyag poharat. Viszonylag több idő eltelik, amikor földre kerül a második, majd a harmadik. A nap előrehaladtával szép lassan egyre jobban gyűlik a szemét a réten a színpadok előtt. Ez a pacemaker szakasz. Aztán egy bizonyos szemétmennyiség után az emberek elkezdenek 'tüzelni': már úgy vannak vele hogy "az én szemetem már nem oszt nem szoroz", így mindenki rövid idő alatt különösebb gátlás nélkül eldobál mindent, így a szemétmennyiség rövid idő alatt megkétszereződik. Ez az akciós potenciál szakasz. Hajnalban amikor vége a bulinak a takarítók fáradságos munkával felszedik az összes szemet - ez a repolarizáció, és a ciklus kezdődik újra.

A szinusz csomóban ez úgy működik, hogy a pacemaker potenciál szakaszban a sejtek a repolarizált szakaszból szép lassan maguktól depolarizálódnak minden féle külső inger nélkül. A depolarizáció azt jelenti, hogy a membrán sejt felöli oldalában nő a pozitív ionok koncentrációja azáltal, hogy a sejtbe ezek az ionok beáramlanak. A depolarizációt több mechanizmus is támogatja. Egyrészt elzáródnak azok a K ion csatornák amiken keresztül kiszivárog a kalium, hogy a sejt ne veszítsen több pozitív iont. Másrészt megnyílnak azok a kalium és natrium csatornák amiken keresztül a sejtbe áramlanak ezek a pozitív ionok is. A Kálium-Nátrium exchanger pumpák pedig 3 Natrium iont szállítanak be a sejtmembránon 2 Kalium ionért cserébe. Szép lassan elkezdenek megnyílni a calcium csatornák is, és ahogy a calcium beáramlik a cardiomyociták sarcoplazmába, ryanodin receptorokra kapcsolódik, ami kiengedi a szarkoplazmatikus retikulum kalcium raktárait, ez pedig hirtelen kalcium fluxot eredményez a sarcoplasmába. Ez a folyamat aktiválja a natrium - calcium exchanger pumpákat, amik 3 Natrium iont szállítanak be 1 kalcium ionért cserébe (így a netto beáramlás 1 pozitív töltés). Ezek a pumpák még több natriumot tudnak a sejtbe szállítani, ami segíti a depolarizációt. A fenti mechanizmusok mind megnövelik a membránpotenciált, ami végül lassan megnyitja az L és T típusú calcium csatornákat, amiken keresztül visszaáramlik az a kalcium is amit előzőleg az exchangerek kivittek a sejtből. Ez a membránpotenciált még poztitívabbá teszi. A lassú depolarizáció a membránpotenciált -70 mV-ról egészen addig növeli, amíg a sejt a tüzelési küszöböt el nem éri (kb -40 mV), vagy pedig amíg egy szomszédos sejt akciós potenciálja nem depolarizája a sejtet. Ez alatt a szakasz alatt nem történik izomkontrakció, így ezt diastoles depolarizációnak is nevezik.
A második szakasz akkor kezdődik, amikor a sejt eléri a tüzelési küszöböt, ez akciós potenciált generál, ekkor az összes L típusú (feszültség-szenzitív) calciumcsatorna gyorsan megnyílik, és a kalciumionok gyorsabban depolarizálják a membrán belsejét (bár ez a folyamat azért lassabb mint a neuronok esetében). Az akciós potenciál szakaszban a membránpotenciál +10 mV-nál csúcsosodik. Az akciós potenciál gyorsan depolarizálja a szomszédos sejteket is, ami így kaszkádként végigfut az egész atriumon (pitvaron), lehetővé téve, hogy az összes pitvarban lévő szívizomsejt egyszerre húzódjon össze.
A harmadik szakaszban történik a repolarizáció, vagyis a membránpotenciál elkezd visszaállni eredeti töltöttségi szintjére (kb -60 mV). Ez úgy történik, hogy egyrészt bezáródnak az L típusú calcium csatornák, amik calciumot engedtek a sejtbe, másrészt megnyílnak azok a Kalium ion csatornák amiken keresztül gyorsan tud kalium kiszivárogni a sejtből, csökkentve ezzel a membránpotenciált. Ezen kívül a Natrium csatornák is inaktiválódnak, ami meggátolja, a Natrium áramlást a sejtbe. Az ionpumpák szintén besegítenek a folyamatba.
A szinusz csomó tehát a fenti mechanizmusnak köszönhetően önmagában is képes ingert generálni, de ezen kívül központi idegrendszeri szabályozás alatt is áll, és emellett a vérben keringő hormonok is befolyásolják működését + az, hogy mennyi vér áramlik vissza a vénákból. A szinusz csomót két ideg szabályozza, melyek a SA node pacemaker sejtjeinek neurotranszmittereket bocsátanak ki: Az egyik a nervus vagus, mely acetylkolint választ ki és a szívritmust lassítja- ez adja a paraszimpatikus inputot, a másik a nervus accelerans, ami viszont gyorsítja a szívritmust azáltal, hogy noradrenalint ereszt szabadon - ez a szimpatikus input. Mindkét ideg kiindulópontja az agytörzs kardiovaszkuláris központjában található a medulla oblongátában - ahol az előző bejegyzésben ismertetett légzésszabályozás és egyéb vegetatív szabályozás is történik. A cardioaccelerator régiók a szimpatikus impulzusokat adnak a nervus acceleransnak, a cardioinhibitor régiók pedig csökkentik a szív aktivitását a nervus vagus paraszimpatikus stimulációja által. Nyugvó állapotban, mindkét központ enyhén stimulálja a szinusz csomót beállítva ezzel a nyugalmi pulzust. Általában a paraszimpatikus stimuláció dominál, mivel a szinusz node idegrendszeri szabályozás nélkül 100 bpm-en működne, így ezt folyamatosan lassítani kell. Ez olyan mint amikor valaki úgy vezet, hogy az egyik lába egy picit mindig rajta van a fékpedálon. Ahhoz, hogy a kocsi gyorsuljon, elég levenni a lábát a fékpedálról.
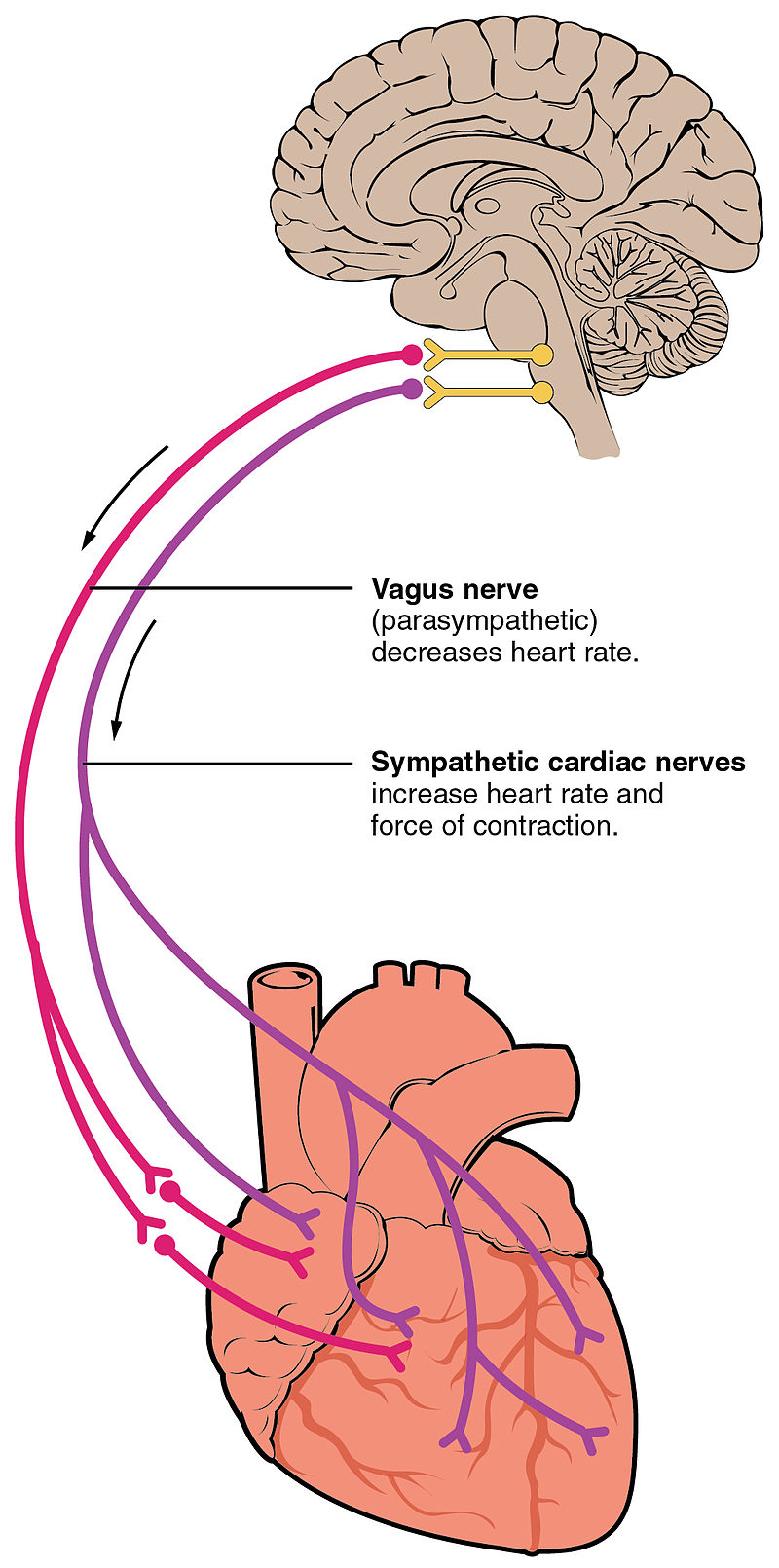
Szimpatikus idegrendszeri szabályozás
A paraszimpatius stimulus tehát a cardioinhibitor régioból érkezik a nervus vaguson keresztül. Ez az ideg aztán további elágazásoknak továbbítja az ingert a SA és AV csomókba, valamint a pitvarok, és kamrák non-pacemaker sejtjeibe. A paraszimatikus inger aztán acetylcholine (ACh) neurotranszmittert bocsát ki a neuromuscularis csomópontokban. Az ACh úgy lassítja a szívfrekvenciát, hogy ligand-gated Kálium ion csatornákat nyit meg, mellyel lassítja a spontán depolarizáció frekvenciáját - ez kitolja a repolarizációs szakaszt, és megnöveli az időt a következő spontán depolarizációig. Ez olyan mintha valahogy rávennénk a fesztiválozókat, hogy kevesebbet szemeteljenek. Innen már láthatjuk, hogy a 'közkedvelt' halálos injekció, a Kalium-klorid miért okoz azonnali szívmegállást.
A cardioaccelerator központ szintén küld mind a SA mind az AV node-okba impulzust + a pitvarokba és kamrákba is rostokat. A szívkamrák sokkal gazdagabban vannak behálózva szimpatikus rostokkal mint paraszimpatikusokkal. A szimpatikus idegrendszeri stimuláció noradrenalin kibocsátást okoz a neuromuscularis csomópontokban. A noradrenalin a cardiomyociták beta 1 receptoraihoz kötődve ligand gated calcium és natrium ion csatornákat nyit meg, ez viszont lerövidíti a repolarizációs periodust, felgyorsítva a depolarizáció frekvenciáját, így növelve a szívfrekvenciát. A szívritmus szabályozó és vérnyomáscsökkentő gyógyszerek egyik népszerű csoportja szelektív kompetitív Beta 1 adrenoreceptor antagonisták, vagyis ezek a gyógyszerek blokkolják a beta 1 receptorokat, meggátolva hogy ligandumok (mint noradrenalin vagy adrenalin ) hozzájuk kapcsolódjanak és aktiválják a megfelelő kalcium ioncsatornákat. Persze a beta blokkolóknál vannak már modernebb gyógyszerek is, pl amik közvetlenül a kalcium ion csatornákat blokkolják, vagy az ACE inhibitorok.
A cardiovascularis központ mérőeszközei
De honnan gyűjt információkat a cardiovascularis központ hogy döntsön a szívritmus szabályozásáról? A cardiovascularis központ egy sor zsigeri receptortól kap ingert - az impulzusukok a zsigeri érző receptorok rostjain végigutaznak a paraszimpatikus és szimpatikus idegekben, és továbbítják az összegyűjtött infot a medulla oblongatanak. A receptorok között vannak a proprioreceptorok (melyek a vázizmok és inak saját mozgásában beállt változást érzékelik), baroreceptorok (nyomásérzékelők), és chemoreceptorok (melyek már tárgyalt módon a ph változásaira érzékenyek) + a nyúltvelő a limbikus rendszertől is kap inputot - ezek mind lehetővé teszik a szívműködés precíz szabályozását.
Proprioreceptorok
A megnövekedett fizikai aktivitás azt eredményezi, hogy megnövekszik a tüzelési frekvencia a külözböző proprioreceptorokban, melyek a vázizmokban, izületi tokban, és inakban találhatók. A cardiovascularis központ monitorozza a megnövekedett tüzelési frekvenciát, és beavatkozik, ha kell a paraszimpatikus stimuláció elnyomásával vagy a szimpatikus stimuláció növelésével, hogy gyorsítsa a véráramlást.
Baroreceptorok
Hasonlóan, a baroreceptorok az erek falainak megnyúlását, a falakra gyakorolt vérnyomást érzékelik. Ezek a receptorok az sinus aorticumban, a venae cavae-ben, és glomus caroticumban vannak. A baroreceptorok tüzelési frekvenciája így leképezi a vérnyomást, a fizikai aktivitás szintjét, vagy a vér relatív eloszlását. A cardiovascularis központ folyamatosan monitorozza a a baroreceptorok tüzelési frekvenciáját is, ezzel fenntartva a cardiohomeostasist, ezt hívjuk baroreceptor reflexnek. Az érfalak elég elasztikusak, így ha az érfalakat ért nyomás nő, az érfal megnyúlik, és a baroreceptorok tüzelési frekvenciája megnő. Erre a cardiovascularis központ úgy reagál, hogy csökkenti a szimpatikus aktivitást, és növeli a paraszimpatikust. Ez olyan mintha a tűzoltó slagot fogó emberke állandóan figyelné hogy a kezeiben mekkora a víz nyomása, és ha a vízsugár túl erős, rögtön szól a kocsiban lévő emberkének, aki lejjebb veszi a vízsugarat.

Chemoreceptorok
Az aktivitás intenzitásának növelésével, a növekvő metabolikus melléktermékeket, pl a CO2, laktát, és proton szintjét + a leeső oxigén szintet érzékeli egy rakat kemoreceptor. A kemoreceptorok visszajelzést adnak a kardiovaszkuláris központoknak, hogy kell- e növelni vagy csökkenteni a vér áramlását, a melléktermékek relatív koncentrációja alapján.
A limbikus rendszer
A limbikus rendszer is jelentősen képes befolyásolni a szívfrekvenciát az érzelmi állapottal összefüggésben. Stressz helyzetben nem szokatlan a normálisnál magasabb HR, melyet gyakran követ cortisol túltengés is. Viszont azt se felejtsük, hogy egy magas intenzitású edzés szintén stressz inger a szervezetnek, főleg ha ehhez egy olyan bizonytalanság is társul, hogy "vajon bírni fogom végig?" A mozgás és a stressz kapcsolatának egy külön sorozatot fogok szentelni, mert egy sor érdekes összefüggés következik belőle. Előljáróban annyit jegyeznék meg, hogy idegrendszerünk evolúciós okokból nem képes a stresszt a mozgás összefüggésein kívül értelmezni, emiatt stressz helyzetben pontosan azok a folyamatok aktiválódnak mint intenzív edzés közben. Viszont mivel az aktivitásra felkészített szervezet a mai modern világban kognitív gátlás miatt legtöbbször nem végez valódi aktivitást stresszválaszként, ez rendesen összezavarja a szervezetet és egy sor rövid és hosszútávú következménye van... Ez valamennyire fordítva is fennál: Az agy nehezen tud mit kezdeni azzal a helyzettel, hogy nem kell üldözni semmit, nem kell menekülni semmi elől, de mégis mozogjunk. Alapjáraton ezért olyan nehéz a mozgásra rávenni magunkat.
A kardiovaszkuláris központ a fenti receptorok segítségével képes a szívfrekvencia relatív pontos szabályozásra, de egyéb faktorok is befolyásolhatják ezt, a legjelentősebbek ezek közül néhány hormon, mint az adrenalin, és noradrenalin vagy thyroid hormonok; különböző ionok szintjei, mint calcium, kalium, és natrium; testhőmérséklet, hypoxia és PH egyensúly.
Az alábbi táblázat tartalmazza azokat a főbb faktorokat amik növelik a HR-t és a szívösszehúzódás erejét (stroke volume).
| Faktor | Folyamat |
|---|---|
| Nervus Cardioaccelerans | |||Noradrenalin kibocsátása |
| Proprioreceptorok | A receptorok megnövekedett tüzelési frekvenciája izomösszehúzódáskor |
| Chemoreceptorok | O2 szint csökkenése, CO2, proton, és tejsav szint növekedése |
| Baroreceptorok | A receptorok csökkenő tüzelési frekenciája mely csökkent vérnyomásra utal |
| Limbikus rendszer | Erős érzelmek, vagy intenzív fizikai aktivitás előrejelzése |
| Katekolaminok | Megnövekedett adrenalin és noradrenalin szint |
| Thyroid hormonok | T3 és T4 szint növekedése |
| kalcium | megnövekedett kalcium ion szint |
| Kálium | Csökkent kálium ion szint |
| Natrium | Csökkent Natrium ion szint |
| Testhőmérséklet | Növekvő testhőmérséklet |
| Koffein, Nikotin | Exobiotikus stimulánsok |
 |
 |
Katekolamin hormonok
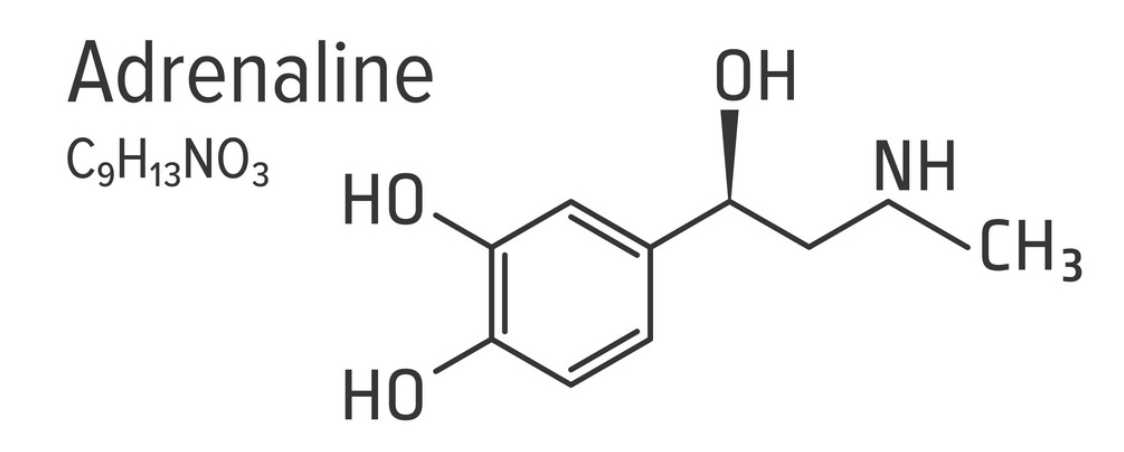
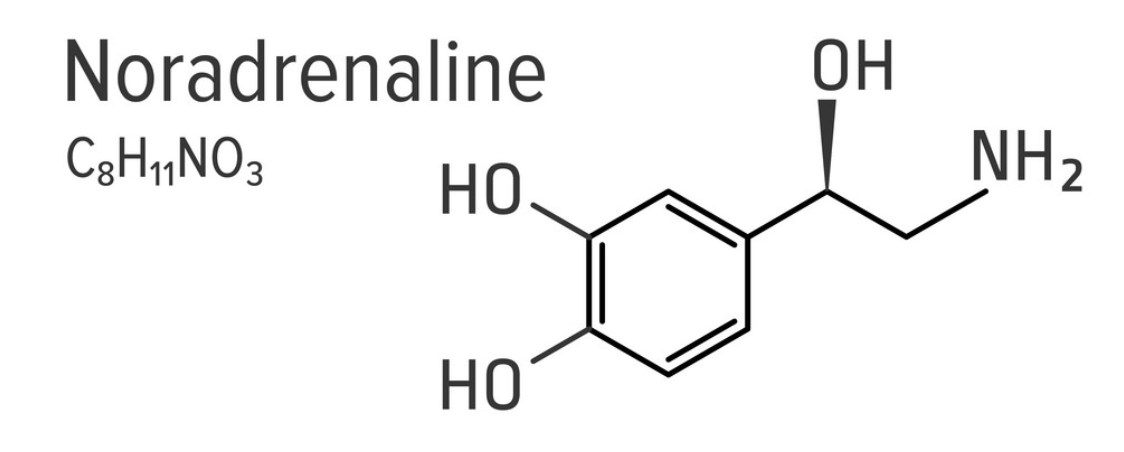
Az adrenalint (ephineprint) és noradrenalint (norephineprint) a mellékvese velő (medulla glandulae suprarenalis) bocsátja ki, a fight-or-flight reflex egyik komponenseként. Az adrenal medulla chromaffin setjei a katekolaminokat tirozin amionsavból szintetizálják. Az L-tirozinból először L-dopa (L-dihidroxi-fenilalalnin) oxidálódik, amit pedig dopa-dekarboxiláz enzim dopaminná alakít eltávolítva a karboxil csoportot. A dopamint a dopamin-beta-hidroxiláz enzim noradrenalinná metabolizálja, úgy hogy a beta szénatomhoz hozzácsap egy hidroxil csoportot. Ehhez a lépéshez aszkorbinsavat (C vitamint) is felhasznál. Ezután adrenalin termeléshez az utolsó lépés a noradrenalin aminocsoportjának metilálása.
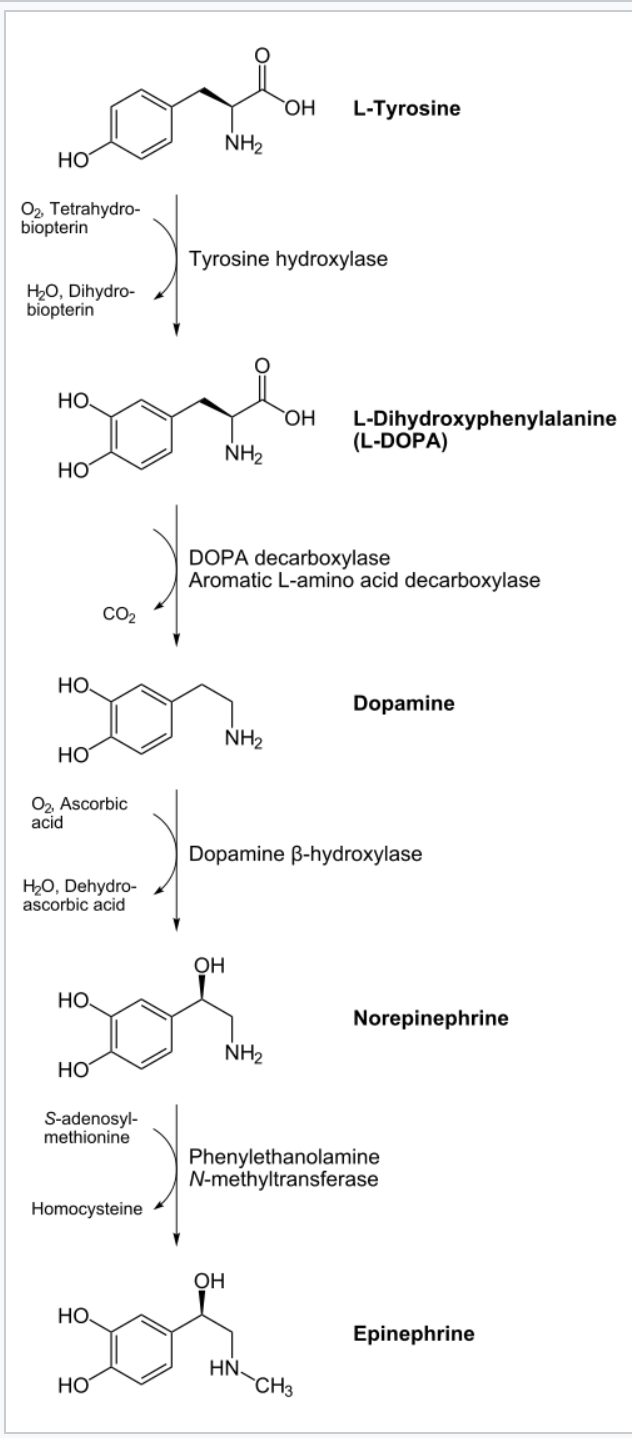
A katekolaminok vérbe bocsátásának 85%-át teszi ki az adrenalin, kb 12-14 %-át noradrenalin, és minimális dopamin is a vérbe kerül. A fight-or-flight reflex másik komponens a szimpatikus idegrendszer, aminek viszont fő neurotranszmittere a noradrenalin, és az adrenalin nem játszik jelentős szerepet neurotranszmitterként. A mechanizmus a hormonok esetén is ugyanaz, mint amikor a noradrenalint a nervus accelerens bocsátja ki: Az adrenalin és noradrenalin a szívizomsejtek beta-1 adrenerg receptoraihoz kapcsolódnak, natrium és calcium ion csatornákat megnyitva. Mivel az extracelluláris matrixban mintegy 10 ezerszer annyi calcium van mint a membrán belső oldalán, a calcium ionok hirtelen beáramlanak a szívizomsejtekbe, hogy a koncentrációgradienst kiegyenlítsék. Ezek a pozitívan töltött ionok megnövelik a depolarizáció frekvenciáját. így a küszöb jóval gyorsabban elérhető a tüzeléshez, és a repolarizáció periodusa is csökken. Ha viszont a szívizmok túl sok ideig vannak kitéve ilyen adrenerg hormonoknak, az akár arrhythmiát is okozhat.
Thyroid hormonok
Általában a megnövekedett Thyroid hormonszint (Tyroxin - T4, és Trijód-tyronin - T3) megnöveli a szívfrekvenciát. A tyroid hormonok hatása jellemzően tovább tart mint a katekolaminoké. A trijód-tironin például közvetlenül behatol a cardiomyocitákba, és genom szinten változtatja meg a működésüket. A beta-adrenerg választ is befolyásolják hasonlóan az adrenalinhez és noradrenalinhez.
Calcium
A kalcium szint nagyban befolyásolja a szívfrekvenciát és kontraktilitást: A megnövekedett kalcium szint mindkettőt növeli. A calcium túl magas szintje akár szívrohamhoz is vezethet. A már említett kalcium-csatorna blokkolók lassítják a szívfrekvenciát ezekhez a csatornákhoz kapcsolódva és ezzel lassítva vagy teljesen blokkolva a calcium befele áramlását.
Exobiotikus stimulánsok
A koffein és nikotin mind központi idegrendszeri és cardiovascularis stimuláns, melyek növelik a szívfrekvenciát. A koffein megnöveli a depolarizáció frekvenciáját a SA csomónál, a nikotin pedig a szimpatikus neuronokat stimulálja, melyek impulzusokat továbbítanak a szívnek. Ezen kívül növeli a pulzust minden olyan központi idegrendszeri stimuláns is, ami valamilyen módon emeli a noradrenalin szintet, tehát az amfetamin (adderal) és származékai (Metamfetamin - speed, Metylén-dioxy-metamfetamin - MDMA - extasy, stb), metylfenidát (ritalin), kokain, DMT, NRI-k (noradrenalin visszavétel gátlók), MAOI-k (monoamin-oxidáz gátlók), stb.. Ezekről szintén lesz egy külön bejegyzés valószínűleg.
Hogyan változik a pulzus amikor növeljük az intenzitást?
Amikor az intenzitás növekszik, először is a vázizmok proprioreceptorai fognak tüzelni, és ingert küldeni a medulla oblongátának. Ezután az érfalon lévő baroreceptorok is érzékelik, hogy a vérnyomás kisebb, mint amennyi szükséges az izmok oxigénellátásához, és ezek is elkezdenek tüzelni, és ingerelni a cardiovascularis centert. Ezután az izommunka melléktermékeként már áramlik is a vérbe a szén-dioxid, ami elkezdi savasítani a vérplazmát - ezt érzékelik a kemoreceptorok is, amik szintén ezerrel kezdenek akciós potenciált generálni a nyúltvelőnek. A nyúltvelő feldolgozza mindezeket az ingereket, és először elnyomja a paraszimpatikus nervus vagus stimulációját. Ez mint láttuk emeli a pulzust egészen 100 bpm-ig, mert a sinus csomó pacemaker sejtjei spontán módon 100 bpm-mel generálnak ingert. Ha az intenzitás tovább fokozódik, a medulla oblongata elkezdi stimulálni a nervus acceleranst, hogy pontosan annyival növelje a szívfrekvenciát és kontrakciók erősségét, amivel biztosítható az izmok tápanyagellátása, és a ph semlegesítése. A nervus accelerans akciós potenciál hatására a neuromuszkuláris szinapszisban szabadon engedi a noradrenalin neurotranszmittereit a vezikuláiból. A noradrenalin aztán a cardiomyociták beta 1 receptoraihoz kapcsolódva elkezdi ingerelni a szívizomsejteket.
Ezután a limbikus rendszer is felébred, mert észbekap, hogy itt bizony hosszú távú intenzív stresszre (terhelésre) kell készülni, és elkezdi aktiválni az egész szimpatikus idegrendszert - beindul a fight-or-flight kaszkád. Bizonyos esetekben a limbikus rendszer aktiválódik előbb - és valójában ez az evoluciós 'normál' működés. Például amikor látjuk, hogy épp előttünk fog elmenni a busz, majd tudatosítjuk, hogy 2 óra múlva jön a következő, a limbikus rendszer azonnal aktiválja a szimpatikus idegrendszert, hogy sprintelni tudjunk. A reakció először az amygdalától indul (nagyjából az agy félelemközpontja), mely aktiválja a hypotalamust, melyet az agyalapi mirígy követ és kortikotropin (ACTH) választódik ki. Ezzel majdnem egyidőben a szimpatikus idegrendszer elkezd túlműködni - az agyban és a perifériákon is megugrik a noradrenalin szint mintegy 10-szeresére a nyugalmi állapothoz képest. A szimpatikus idegrendszer stimulálja mellékvese mirígyeit is, hogy villámgyorsan katekolaminokat válasszon ki a vérbe - főleg adrenalint, de kis mértékben noradrenalint, és minimális dopamint is. A szimpatikus és hormonális toborzás eredményeképpen a szervezet mobilizálja energiaraktárait és átáll katabolizmusra: a metabolizmus gyorsul, az alfa-adrenoreceptorok stimulálása meggátolja, hogy a hasnyálmirigy inzulint válasszon ki, viszont ezerrel megindul az izom-glikogén lebontása, gyorsul az izmokban a glikolízis (cukorbontás), a májban is növekszik a glikogenolisis (a glikogénbontás) ; az emésztőrendszerben és a bőrben a vérerek összehúzódnak, míg a simaizomszövetekben és vázizmokban kitágulnak, így a vér az izmokba áramlik inkább a mozgáshoz kevésbé szükséges szervek helyett; az artériák összehúzódnak, ami emeli a vérnyomást; az agyban nő az éberség, a koncentráltság, az izgalmi állapot; a a hasnyálmirigy beta receptorainak stimulálása kiereszti a glükagon raktárait, ami emeli a vércukor szintet , stb... Ha az intenzitás a határterhelés irányába megy, elkezd kortizol is kiválasztódni a mellékvesekéreg vezikuláiból, ami jelentősen megdobja a vérnyomást, tovább emeli a vércukor szintet és elnyomja az immunrendszert is.
A beta1 receptorokhoz kapcsolódva mind az adrenalin mind a noradrenalin növeli a szívfrekvenciát (heart rate - HR), a szívizom-kontrakció erősségét (stroke volume - SV) , és a szív vezetési képességét is. Ezek összességében mind azt eredményezik, hogy nagyobb mennyiségű vér jut egységnyi idő alatt a szervezet sejtjeihez. A beta 1 receptorok G-protein-linked receptorok, melyek noradrenalin és adrenalin hatására közvetlenül L-típusú calcium ion csatornákat nyitnak meg a plazma membránban. A szívizomsejtekben a kalcium csatornák megnyitása kalciumáramlást indít meg az extracelluláris mátrixból a sejtbe, mely intracelluláris kalcium kibocsátást vált ki a szarkoplazmatikus retikulumból a ryanodine receptor (RyR 2) aktiválása által (kalcium által kiváltott kalcium kibocsátás). Emelett a beta-1 receptor stimulálása még egy bonyolultabb láncreakciót is elindít: Adenilyl-cikláz enzimet aktivál, ami az elérhető ATPből megnövekedett cAMP (ciklikus-adenozin-monofoszfát) szintet eredményez; ez aktiválja a protein-kináz-A enzimet, ez pedig foszforizál néhány targetet, mint magát a calcium csatornát, + foszfolambant, Troponin l-t, és kalium csatornákat is. A calcium csatorna foszforizálása megnöveli annak a valószínűségét, hogy nyitva maradjon, és így lehetővé teszi, hogy még több calcium bejusson a myocitába a depolarizációs szakaszban, rövidítve azt az időt ami szükséges a tüzelési küszöb eléréséhez. A foszfolamban foszforizálása, deaktiválja annak működését, mely normál esetben blokkolná a az ATP-áz enzimet sarcoplazmatikus retikulumban (SR), ennek eredményeképpen az akciós potenciál után több calcium lép be a SR-ba, és felhasználható a következő depolarizációhoz. Mindkét mechanizmus megnöveli a kontrakcióhoz elérhető calcium mennyiségét, és így növeli a kontraktilitást is. A troponin-l foszforizálása ezzel szemben azt eredményezi, hogy kontrakció után a calcium könnyebben disszociál a troponinC-ről, ami gyorsítja az izomelernyedést a repolarizációs szakaszban. A kalium csatornák foszforizálása pedig ennek is megnöveli a valószínűségét, hogy nyitva maradjon, így több kalium tud kiszivárogni a repolarizációs szakaszban, és így lerövidíti azt, növelve a szívfrekvenciát. Az adrenalin injekció így kiválóan használható szívelégtelenség esetén, hogy megnöveljük a szív kibocsátását.
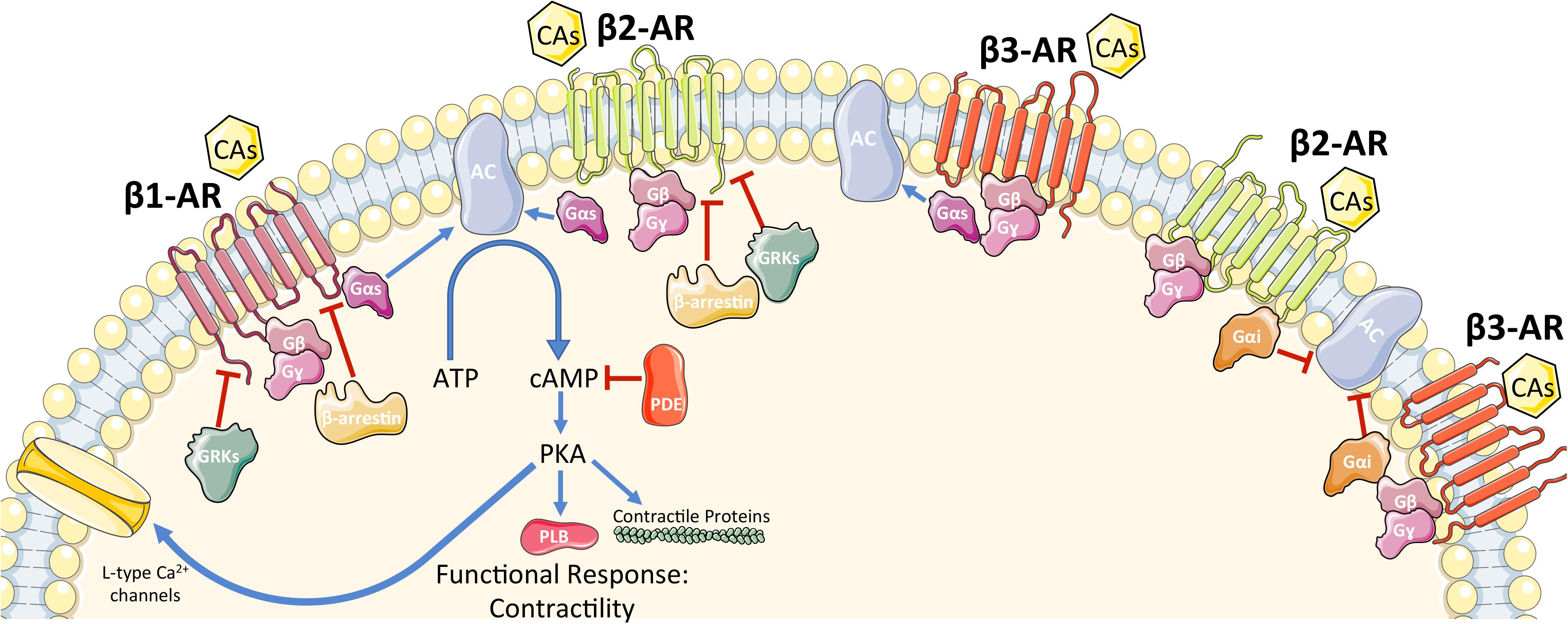
A depolarizációs és repolarizációs szakasz rövidítése tehát megnöveli az akciós potenciálok frekvenciáját, a szívizmok pedig akciós potenciál hatására húzódnak össze. De erről asszem inkább a következő részben lesz szó, mert kezd itt elszaladni velem a ló :) A következő részben szó esik mindarról ami az akciós potenciálok után történik: hogy hogyan húzódnak össze a szívizmok, hogy néz ki egy cardio-ciklus, milyen faktorok befolyásolják a szív kibocsátását, hogyan táplálkozik maga a szív, és milyen veszélyeket rejt a hypoxia.
TLDR:
1. Az intenzív edzés során az izmoknak több tápanyagra van szüksége és gyorsabban kell hozzájutniuk
2. Ezt a vér áramlásának gyorsításával lehet megtenni, mely a pulzus és a szív összehúzódások erejének növelésével érhető el.
3. A szív az egyetlen izom ami spontán önmagának képes ingert generálni az összehúzódáshoz
4. A szívfrekvenciát ezen kívül több mechanizmus is szabályozza: izmok proprioreceptorai, vérnyomás érzékelő receptorok, kemoreceptorok, és hormonok
5. A szívkibocsátás gyorsítása tipikusan beta 1- adrenerg agonista hormon/neurotranszmitter kibocsátásával érhető el, a két leggyakoribb, az adrenalin, és a noradrenalin, mindkettő a szívizmok beta-1 receptoraihoz kapcsolódik és növeli a szívfrekvenciát és a kontraktilitást is.
6. Intenzív edzés hatására egy idő után bekapcsol a fight-or-flight reflex valamilyen formája: a szervezet mobilizálja energiaraktárait és átáll katabolizmusra: megindul az izom-glikogén lebontása, gyorsul az izmokban a glikolízis (cukorbontás), a májban is növekszik a glikogenolisis (a glikogénbontás) ; az emésztőrendszerben és a bőrben a vérerek összehúzódnak, míg a simaizomszövetekben és vázizmokban kitágulnak, így a vér az izmokba áramlik inkább a mozgáshoz kevésbé szükséges szervek helyett; az artériák összehúzódnak, ami emeli a vérnyomást; az agyban nő az éberség, a koncentráltság, az izgalmi állapot; a vércukor szint emelkedik, stb...
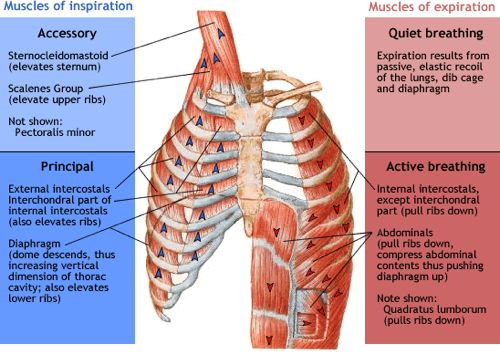
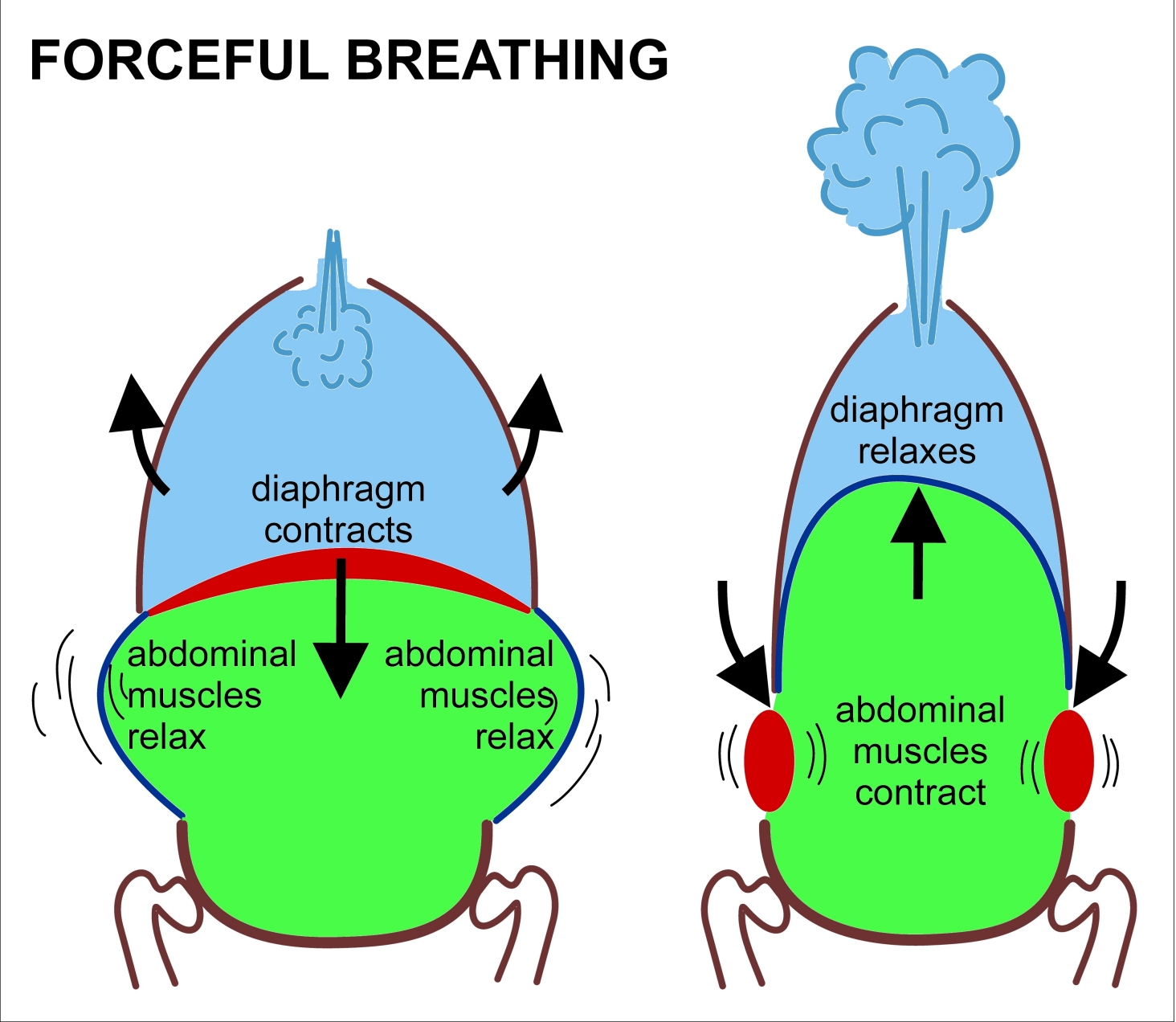
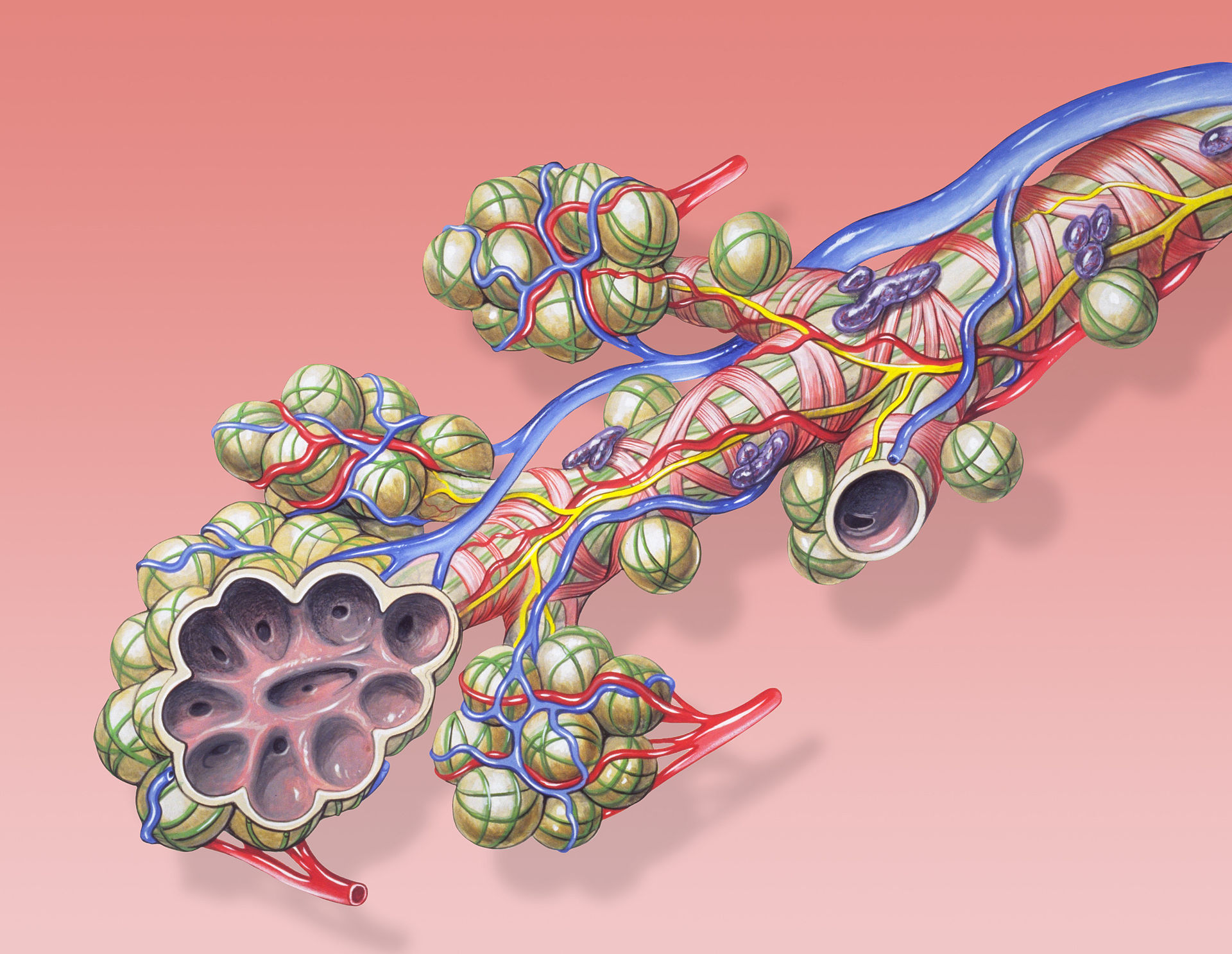
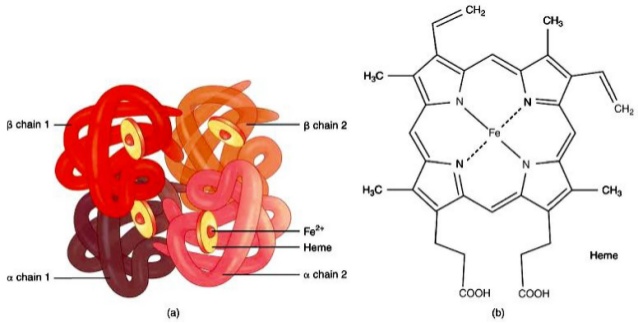
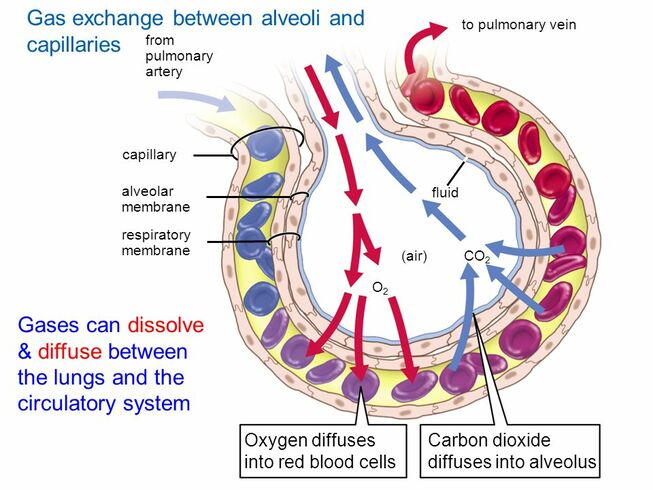 Az oxigén a véráramban elég rosszul oldódik, ezért vörösvértestek szállítják a szervezet különböző pontjaira. A vörösvértestek szervezetünk összes sejtjének 70%-át alkotják, és nem rendelkeznek sem sejtmaggal, sem mitokondriummal. Tartalmaznak viszont jó sok haemoglobint (úgy 270 milliót sejtenként), mely egy 4 fehérjekomplexből (globinból) álló struktúra. Mindegyik fehérjekomplex közepén egy vas (II) atom található, mely oxigént tud felvenni így a haemoglobin 4 oxigén molekula szállítására képes.
Az oxigén a véráramban elég rosszul oldódik, ezért vörösvértestek szállítják a szervezet különböző pontjaira. A vörösvértestek szervezetünk összes sejtjének 70%-át alkotják, és nem rendelkeznek sem sejtmaggal, sem mitokondriummal. Tartalmaznak viszont jó sok haemoglobint (úgy 270 milliót sejtenként), mely egy 4 fehérjekomplexből (globinból) álló struktúra. Mindegyik fehérjekomplex közepén egy vas (II) atom található, mely oxigént tud felvenni így a haemoglobin 4 oxigén molekula szállítására képes.